SPONDYLOARTHRITE
Pénétrance faible du HLA-B27
Le risque de développer une SpA chez les porteurs de l’allèle HLA-B27 est multiplié environ par 40 par rapport aux non-porteurs . Il n’est cependant ni nécessaire, ni suffisant à sa survenue. En effet, près de 20 % des malades ne sont pas porteurs de cet allèle . De plus, parmi les porteurs du HLA-B27, seuls 3 à 5 % développent une SpA [66, 67]. Ce pourcentage passe à 20% chez les patients HLA-B27+ apparentés à un malade suggérant la présence d’autres facteurs génétiques partagés. L’étude de paires de jumeaux B27+ conforte cette hypothèse puisque la différence du taux de concordance entre jumeaux monozygotes et dizygotes persiste si l’on ne considère que les individus B27+ .
Polymorphisme
Le système HLA possède un polymorphisme qui se traduit par un nombre important d’allèles pour chaque locus. Plus de 105 variants alléliques HLA-B27 ont été découverts à travers le monde [62]. Tous dérivent d’un allèle ancestral l’HLA-B*2705, sous-type le plus répandu et présent chez 90 % des patients HLA-B27+ d’origine caucasienne [28, 63, 65, 64, 69]. d) HLA B27 et spondyloarthrites Plusieurs hypothèses ont été proposées pour expliquer le rôle du HLAB27 dans le déterminisme de la SpA. On distingue les théories dites spécifiques et les théories non spécifiques d’antigène. Hypothèse du peptide arthritogène. Des peptides exogènes bactériens, ayant une homologie de séquence avec ces peptides arthritogènes, pourraient être présenté par HLA et initier une réponse cytotoxique .
Hypothèse du mimétisme moléculaire
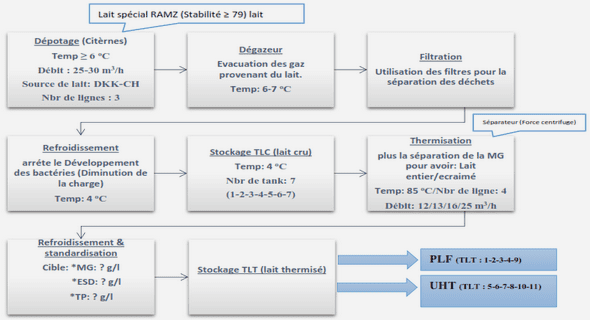
Les anticorps dirigés contre des motifs peptidiques bactériens pourraient avoir une réaction croisée avec l’antigène tissulaire HLA-B27 . L’observation ayant servi de trame à l’élaboration de cette hypothèse était la forte association des AR à l’antigène tissulaire HLA-B27 d’une part, et d’autre part la comparaison avec d’autres pathologies comme le rhumatisme articulaire . Misfolding Il s’agit d’un mauvais repliement de la molécule HLA B27 dû à la présence d’acidesaminés particuliers au niveau de la poche B de fixation du peptide antigénique, notamment la cystéine en position. Cette dernière serait à l’origine de la formation de ponts disulfures qui engendreraient la création anormale d’homodimères de chaînes lourdes non associés à la β2m. L’accumulation d’homodimères ou d’HLA-B27 mal repliés dans le réticulum endoplasmique, par défaut des processus de dégradation, provoquerait un stress cellulaire dirigé par des protéines UPR (Unfolded Protein Response) responsables de l’activation du facteur de transcription NFκB (Nuclear Factor kappa B) et de la réponse inflammatoire par induction de cytokines proinflammatoires telles que le TNFα (Tumor Necrosis Factor alpha), l’IL-1 (Interleukine 1) et l’IL-6 (Interleukine 6) . D’autres hypothèses en rapport avec HLA-B27 ont été évoquées : – L’accumulation de β2m – Un changement de conformation tridimensionnelle la chaîne lourde de HLA-B27 non liée à la β2m ni au peptide antigénique. Figure 3. Schéma récapitulant les principales hypothèses moléculaires concernant la pathogénicité du HLA-B27 [59]. 1 : après leur assemblage normal dans le réticulum endoplasmique et leur exportation à la membrane plasmique par l’appareil de Golgi et la voie de l’exocytose, des formes matures d’HLA-B27 présentent un peptide « arthritogène » reconnu par le récepteur de lymphocytes T CD8+ pathogènes qu’elles stimulent. 2 : les formes mal repliées d’HLA-B27, dépourvues de peptide et de β2m s’accumulent dans le réticulum endoplasmique et déclenchent une réponse de « stress du réticulum ». 3 : des dimères de HLA-B27 dépourvus de peptide et de β2m se forment par recyclage dans les endosomes de molécules HLA-B27 exprimées à la membrane plasmique. Ces dimères d’HLA-B27 sont à leur tour exprimés à la surface cellulaire où ils interagissent avec des récepteurs de type NK (KIR3DL2 ou LILRB F)
INTRODUCTION |