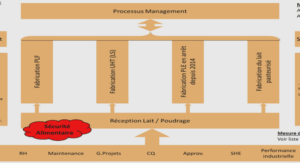
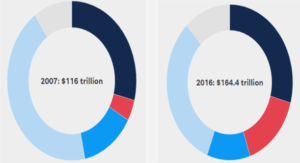
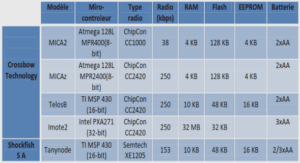
DETERMINATION DE LA STRUCTURE PRIMAIRE DE INTEGERRIMACYCLOPEPTIDE A
Analyse des spectres
Le spectre RMN 1
H à une dimension de intégerrimacyclopeptide A en solution dans le DMSO à 313 K fait apparaître une conformation majoritaire (supérieure 90 %) permettant son analyse (Fig. 18).
Trois régions peuvent être distinguées sur le spectre.
– Entre 7,3 et 8,7 ppm, on a la région des protons amides présentant huit doublets à 7,30; 7,60 ; 7,62 ; 7,64 ; 8,16 ; 8,28 ; 8,53 et 8,56 ppm attribuables respectivement à des résidus monoalkylés qui sont Ile, Ser, Leu, Ile, Gly, Ile, Gly et Leu.
– La région des protons α est observée entre 3,3 et 5,0 ppm où l’on trouve aussi le proton de l’hydroxyle de la sérine représenté par un singulet à 5,82 ppm.
– Entre 0,7 et 3,8 ppm sont observés les protons des groupements CH, CH2 et CH3 des chaînes latérales.
Le spectre COSY met clairement en évidence les couplages scalaires entre le proton amide et le proton α du même résidu (Fig. 19).
La complexité du spectre liée à l’encombrement de certains signaux amène à exploiter en combiné les spectres COSY et TOCSY. Ce dernier faisant apparaître pour chaque acide aminé l’ensemble des protons qui lui sont propres (Fig. 20). Sont ainsi identifiés les systèmes de spins des acides aminés suivants : Leu, Gly, Ile, Gly, Ile, Leu, Ser et Ile partant du NH de chacun de ces résidus.
Détermination de la séquence par HMBC
L’analyse du spectre HMBC, par l’observation des interactions d’un carbonyle avec les protons NH, α et β a permis leurs attributions et leurs corrélations avec le NH du résidu suivant la détermination de la séquence (Fig. 24).
Les résidus sont ensuite reliés les uns aux autres à l’aide des corrélations 2 JCH entre le carbonyle d’un résidu et le proton amide du résidu suivant et/ou des corrélations 3 JCH entre ce carbonyle et le proton α du résidu suivant qui sont mises en évidences dans l’expérience HMBC.
Cette méthode hétéronucléaire de détermination de la séquence est préférable à la méthode homonucléaire décrite par Wüthrich car pour les peptides cycliques de petites tailles les informations (NOESY) conformationnelles peuvent interférer avec les informations séquentielles et être source d’ambiguïté.
Le spectre HMBC montre une corrélation entre le carbonyle de Gly2 à 168,5 ppm et le NH dela Ser3 , le carbonyle de la Ser3 est corrélé au NH de Ile4 ; le carbonyle de Ile4 est corrélé au NH et au proton α de Ile5 ; le carbonyle de Ile5 est corrélé au NH, au proton α, β et δ de Leu6 ; le carbonyle de Leu6 est corrélé au NH et au proton α de Gly7 , le carbonyle de Gly7 au NH et au proton α de Ile8 et le carbonyle de Ile8 est corrélé au NH et au proton α de Leu1.
Séquençage de intégerrimacyclopeptide A selon la stratégie de Wüthrich
Le séquençage par RMN homonucléaire est réalisé par l’observation des corrélations de type dNN (i, i+1) et de type dαN (i, i+1) sur le spectre ROESY.
Le spectre ROESY montre des interactions dαN (i, i+1) entre le proton α de Gly7 et le NH de Ile8 , le proton α de Gly2 et le NH de Ser3 ; le proton α de Leu6 et le NH de Gly7 , le proton α de Ser3 et le NH de Ile4 , le proton α de Leu1 et le NH de Gly2 , le proton α de Ile8 et le NH de Leu1 , le proton α de Ile5 et le NH de Leu6 . L’analyse du spectre de ROESY (Fig. 26) permet d’avoir la séquence suivante : cyclo (Leu1 -Gly2 -Ser3 -Ile4 -Ile5 -Ile6 -Gly7 -Ile8 ), structure identique à celle proposée par l’interprétation des données HMBC.
Détermination de la structure primaire de intégerrimacyclopeptide B
Sur le spectre RMN 1
H à une dimension de intégerrimacyclopeptide B, on peut distinguer trois régions qui sont : la région des protons amides qui se situe entre 6,4 et 9,2 ppm, la région des protons α entre 3,2 et 5,3 ppm où l’on retrouve le proton de l’hydroxyle de la Thr et la région des protons des groupements CH, CH2 et CH3 des chaînes latérales qui est entre 0,6 et 2,6 ppm (Fig. 27).
On peut donc établir la structure d’intégerrimacyclopeptide B qui est la suivante : cyclo (Pro1 -Gly2 -Thr3 -Ile4 -Gly5 -Ile6-Leu7 ).
Le spectre ROESY (Fig. 30) montre des interactions dαN(i, i+1) entre le proton α de Ile6 et le NH de Leu7 , le proton α de Ile4 et le proton amide de Gly5 , le proton α de Gly2 et le proton amide de Thr3 et le proton α de Gly5 et le proton amide de Ile6 ; le proton α de Thr3 et le proton amide de Ile4 . Enfin la corrélation entre le proton α de Pro1 et le proton amide de Gly2
.