L’hypertension artérielle représente un problème majeur de santé publique car elle est à l’origine de nombreux accidents vasculaires cérébraux, cardiaques et rénaux, et d’une mortalité accrue. A côté des facteurs liés aux anomalies du système vasculaire lui-même, il est maintenant bien compris qu’un défaut d’excrétion du sodium, et donc généralement un dysfonctionnement rénal, est à l’origine de certaines formes d’hypertension artérielle.
La vasopressine est une hormone qui joue un rôle essentiel dans la conservation de l’eau en permettant de concentrer les solutés excrétés dans l’urine. En fait, elle a deux effets majeurs, un effet antidiurétique et un effet vasoconstricteur. L’idée que la vasopressine puisse jouer un rôle dans le contrôle de la pression artérielle a été fréquemment avancée en raison de son puissant effet vasoconstricteur bien démontré in vitro, mais les nombreux travaux explorant cette hypothèse in vivo n’ont pas été concluants. Par contre, peu de travaux ont été consacrés au fait que la vasopressine puisse contribuer à l’hypertension artérielle d’une manière indirecte, par ses effets sur le rein.
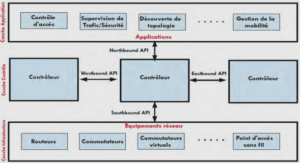
Architecture générale du rein
Chez les mammifères, le rein a une fonction et une organisation complexes, comprenant un réseau vasculaire très développé et un grand nombre d’unités fonctionnelles, les néphrons (environ 1 million de néphrons par rein chez l’Homme et 30 000 néphrons par rein chez le rat). L’examen macroscopique d’un rein de rat – après injection de silicone blanc dans l’artère rénale et coupe longitudinale – permet de voir cette vascularisation et de distinguer deux zones :
– le cortex, situé en périphérie du rein, sous la capsule,
– la médulla, subdivisée en médulla externe (comprenant une zone externe, OS = outer stripe, et une zone interne, IS = inner stripe) et médulla interne, et qui se termine en une « papille » de forme conique.
Les néphrons sont constitués de deux parties successives, le glomérule et le tubule rénal.
Le glomérule est formé par un peloton de capillaires entourés par une capsule conjonctivo-épithéliale appelée capsule de Bowman. L’ensemble des glomérules permet chez l’Homme la filtration d’environ 180 litres de plasma par jour. Chaque glomérule se poursuit au pôle urinaire par un tubule rénal formé de cellules épithéliales et entouré d’un réseau de capillaires péritubulaires très important. Ce tubule rénal comprend :
– un tubule proximal contourné puis droit ,
– un segment grêle descendant et (pour les néphrons à anse longue) un segment grêle ascendant ,
– un tubule distal droit , appelé aussi segment large ascendant, puis un tubule distal contourné . Les structures n°3, 4, 5 et 6 réunies forment une structure en épingle à cheveux appelée anse de Henle. Il existe deux types d’anse de Henle (courte et longue) et on distingue donc les néphrons à anse courte et à anse longue . Ils ont des caractéristiques fonctionnelles différentes, mais qui n’ont pas été prises en considération dans ce travail de thèse.
Chaque tubule contourné distal se poursuit par un tubule connecteur (n°9) qui se jette dans un canal collecteur (CC) (n°10, 11 et 12). Les CC confluent les uns avec les autres pour devenir de plus en plus larges à mesure qu’ils s’enfoncent dans le rein et ils débouchent finalement dans le pelvis. Cette position finale donne au CC une importance tout à fait particulière. En effet, tout échange de solutés entre lumière et plasma dans cette partie du néphron ne pourra pas être compensé à court terme par un autre segment et donc retentira directement sur la composition de l’urine. Ces CC sont bordés par deux types de cellules épithéliales, les cellules principales et les cellules intercalaires, qui diffèrent par leur morphologie et leur fonctionnalité. Toutes les cellules épithéliales du néphron, liées entre elles par des jonctions serrées, sont polarisées et comportent une membrane apicale du côté de la lumière tubulaire, et une membrane basolatérale du côté des liquides extracellulaires. Ces deux membranes n’ont pas les mêmes propriétés et contiennent des transporteurs différents, ce qui permet d’assurer des transports unidirectionnels de différentes molécules entre lumière et plasma ou vice versa.
Étapes de formation de l’urine
Filtration glomérulaire
Le processus de formation de l’urine commence par une ultrafiltration du plasma (environ 180 litres par jour chez l’Homme) au niveau des capillaires du glomérule, qui ne laissent passer que les molécules de faible poids moléculaire. Cette ultrafiltration glomérulaire produit une « urine primitive » qui a approximativement la même composition ionique que le plasma, mais qui est dépourvue de cellules sanguines et de macromolécules. L’urine primitive passe ensuite dans les tubules rénaux où elle va subir des changements de composition pour devenir l’urine finale.
Réabsorption et sécrétion tubulaires
L’une des modifications de la composition de l’urine primitive est due à la réabsorption tubulaire d’eau et de certains solutés de la lumière tubulaire vers les capillaires péritubulaires. Ce transport à travers les cellules épithéliales qui tapissent les tubules rénaux permet la conservation de substances essentielles pour le bon fonctionnement de l’organisme. Un grand nombre d’entre elles, comme le glucose et les acides aminés par exemple, sont réabsorbées exclusivement par le tubule proximal, tandis que d’autres, comme l’eau et le sodium, sont réabsorbées aussi à des sites plus distaux du néphron.
Parallèlement à la réabsorption tubulaire, la composition de l’urine primitive peut être modifiée par l’ajout de certains solutés des capillaires péritubulaires vers la lumière. Cette sécrétion tubulaire permet notamment d’éliminer de façon plus efficace certains composés et donc de maintenir leur taux plasmatique à un niveau plus bas.
Dilution et concentration de l’urine
Dans les conditions de vie normale, l’osmolalité plasmatique de l’Homme et de la plupart des mammifères est précisément maintenue entre 290 et 300 mosm/kg H2O, quels que soient les apports et les excrétions d’eau et de solutés. Le maintien de cette valeur dépend essentiellement de la capacité du rein à réguler indépendamment l’élimination de l’eau et des solutés. De plus, l’osmolalité urinaire de l’Homme se situe le plus souvent entre 250 et 800 mosm/kg H2O. Cette variabilité de pression osmotique de l’urine est rendue possible grâce à la capacité du rein soit à diluer l’urine (ce qui permet d’excréter un excès d’eau sans perdre de solutés) soit à concentrer des solutés dans l’urine (ce qui permet d’excréter ces solutés en économisant de l’eau). Ces fonctions d’excrétion sélective de l’eau ou des solutés existent, d’une part grâce à l’architecture particulière du rein, mais surtout grâce à la combinaison de plusieurs effets de la vasopressine sur cet organe .
INTRODUCTION |