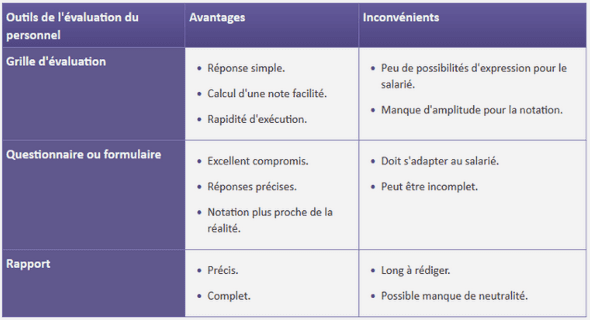
YNTHESE BIBLIOGRAPHIQUE
GENERALITES SUR LE SORGHO
La systématique du sorgho
Le genre sorghum a été classé de plusieurs manières, mais la classification la plus utilisée actuellement est celle établie par Moench. Dans le genre sorghum, on distingue trois espèces, dont sorghum bicolor (L.) Moench qui comporte un ensemble de sorghos de types sauvages africains, de types dérivés, de types adventices et des sorghos cultivés. Parmi les sorghos cultivés, Harlan et de Wet (1972) ont mis au point, à l’usage des sélectionneurs une classification simplifiée et informelle des sorghos cultivés et des sorghos sauvages les plus proches. Les taxons cultivés sont subdivisés entre les races suivantes: bicolor, guinea, caudatum, kaffir et durra. Hormis ces races cultivées, on distingue au sein de ce groupe 10 autres races hybrides (House,1987).
La distinction entre ces différentes races est basée essentiellement sur les caractéristiques de la panicule ainsi que sur la forme des grains. En zone sahélienne d’Afrique occidentale, parmi les variétés traditionnelles détenues par les paysans, 4 des 5 races citées précédemment sont présentes: bicolor, guinea, caudatum et durra avec une très grande prépondérance de la race guinea (Clerget, 1999).
La phase végétative
Elle va de la germination à l’initiation paniculaire. Lorsque la semence est enfouie dans le sol humide, elle s’imbibe d’eau et se gonfle. La germination se produit rapidement, et elle est plus rapide dans les sols chauds (20°C ou plus). Le coléoptile apparaît le premier au-dessus du sol au bout de trois à quatre jours mais le temps d’apparition peut s’allonger jusqu’à dix jours dans les sols plus froids (13-20°C). Commencent ensuite à se développer quelques racines primaires. A l’émergence du coléoptile du sol, la première feuille sort en perçant son sommet. La jeune plante commence sa croissance en produisant d’autres feuilles et le coléoptile reste à la base du pied sous forme d’une gaine. Le mésocotyle croît durant cette période et un nœud se forme à la base du coléoptile juste en dessous de la surface du sol. Des racines secondaires ou racines adventives commencent à se développer au niveau de ce nœud, trois à sept jours après l’émergence du plant. La jeune plantule vit durant cette période sur les éléments nutritifs stockés dans l’endosperme. Pendant la phase végétative on observe le développement de la partie aérienne prioritairement par rapport aux racines. Ceci est confirmé par Clerget (1999) qui montre que le rapport de la masse sèche aérienne sur masse sèche racinaire commence à augmenter depuis la levée jusqu’au 22e jour après levée d’où la priorité de développement de la partie aérienne au cours de la phase végétative. Ce n’est qu’entre le 20e et le 40e jour après la levée qu’intervient une phase de croissance rapide des racines qui se situe déjà dans la phase reproductive. Il s’accumule alors une masse racinaire supérieure à celle de la masse aérienne. Dans la figure 1 la phase végétative correspond au stade 1.
Les sorghos sont généralement photosensibles de jours courts. Leur floraison est retardée quand la photopériode dépasse une valeur seuil qui est caractéristique de la variété et de sa latitude d’origine (Ouattara et al, 1998). Le seuil photopériodique pour les variétés tropicales est souvent compris entre 12 et 13 heures et pour le matériel de la zone tempérée, la valeur critique passe à plus de 14 heures. Elle est indispensable pour déclencher le processus de l’initiation paniculaire et sa variation influe significativement sur la durée de la phase végétative. Major (1980), Ritchie et Alagarswarmy (1991) montrent que le cycle végétatif augmente proportionnellement à la longueur du jour, au-delà de la valeur seuil. Ils montrent également que la photosensibilité n’a pas d’effet sur le rythme d’apparition des feuilles de sorte que le nombre de feuilles produites augmente quasi proportionnellement avec la durée de la phase végétative, qui elle est variable en fonction du cycle de la variété de sorgho considérée. Pour un cycle de 90 jours, la phase végétative s’étale sur 30 jours mais peut aller jusqu’à 40 jours (Sène, 1999). Ils montrent aussi que la phase végétative peut être subdivisée en deux grandes phases, une phase d’insensibilité à la photopériode, dite juvénile durant jusqu’à environ 15 jours après semis et variant en fonction des variétés (Ritchie et Alagarswarmy, 1991), et une phase de développement végétatif conduisant à l’initiation paniculaire c’est à dire le passage du méristème apical de l’état végétatif à l’état reproducteur durant les 15 jours qui restent. Cette dernière est sensible à la photopériode.
Au cours de la phase végétative, le tallage est un phénomène qui est prépondérant chez les sorghos et correspond à l’émission d’une nouvelle tige à la base ou à l’aisselle des feuilles. Les talles prennent naissance à partir de bourgeons adventifs au nœud basal aussitôt après la sortie des racines secondaires. Cette capacité de tallage est variable selon le type de sorgho et selon les variétés. Les sorghos fourragers tallent plus que les sorghos grains. Clerget (1999) a montré sur deux variétés de sorgho (Nazongala et Sariaso 10) étudiées en conditions d’alimentation en eau non limitante que chez Nazongala, chaque plante a produit 5 talles tandis que leur nombre était limité à trois chez Sariaso 10. Les talles émises peuvent porter des inflorescences tout comme la tige principale, et la formation de leurs fleurs peut se faire en même temps ou après celle de la tige principale. Cependant il n’a pas pu identifier l’effet de stress hydrique sur l’émission des talles, mais il a pu montrer que le stress hydrique n’a pas réduit le nombre de talles déjà existantes et que même après l’irrigation, les talles ont crû à la même vitesse, sans que la compétition puisse être favorable aux plus précoces, en particulier à la tige principale.
La phase reproductive
Elle va de l’initiation paniculaire à la fécondation (stade 2 de la figure 1). Les ébauches florales initiales apparaissent 30 à 40 jours après la germination en général, et leur apparition marque la fin de la période végétative. La grande période de croissance chez le sorgho suit la formation du bourgeon floral et est basée essentiellement sur l’élongation cellulaire. Environ 6 à 10 jours avant la floraison, la feuille paniculaire forme un renflement dans la gaine de la feuille. Le sorgho fleurit en général au bout de 55 à 70 jours après la germination dans les climats chauds. La panicule du sorgho commence à fleurir à partir du sommet et la floraison se poursuit par étage successif en allant vers le bas durant une période de quatre à cinq jours. La période allant de l’initiation paniculaire à la floraison est particulièrement déterminante pour la production (Sène, 1999) car le nombre potentiel de grains par plante y est fixé (Lee et al, 1974; Peacock et Heinrich, 1984).
Le sorgho est une plante autogame, mais on peut rencontrer des cas d’allogamie. Ce sont essentiellement les stigmates de la partie supérieure de la panicule exposés avant que ne commencent les premières libérations de pollen qui expliquent un certain pourcentage de pollinisation croisée chez le sorgho (Chantereau et Nicou, 1991). Après la pollinisation, le pollen produit un tube pollinique à deux noyaux qui descend à travers le style pour féconder l’ovule et former un noyau à 2n chromosomes et un endosperme à 3n chromosomes. Le sorgho a une garniture chromosomique de 20x chromosomes.
Le remplissage et la maturation des graines
Après la fécondation, l’évolution de l’ovule aboutit au développement d’une sphère vert clair à presque crème. Après dix jours, elle prend du volume et passe au vert foncé. Il faut environ 30 jours aux graines pour atteindre leur poids sec maximum ou maturité physiologique. Elles contiennent à ce moment environ 30% d’humidité et sèchent jusqu’à 10-15% d’humidité durant les 20-25 jours qui suivent. La graine peut être récoltée à n’importe quel moment entre la maturité physiologique et la siccité de la graine, toutefois les graines qui ont plus de 12% d’humidité doivent être séchées avant stockage (House, 1987). Dans la figure 1 cette phase correspond au stade 3.
Les facteurs écologiques de la culture du Sorgho
Le sorgho est une céréale importante pour les zones chaudes à pluviométrie réduite de la zone tropicale sahélienne du fait de sa plasticité qui lui permet de croître dans des zones diverses (Chantereau et Nicou, 1991). En effet, on le cultive de la zone tropicale à la zone tempérée. On le rencontre en altitude sous des pluviométries importantes comme au Rwanda, en zone désertique sous irrigation ou hors saison d’irrigation ou hors saison de pluies, se contentant alors de l’eau disponible dans certains sols comme au Nord Cameroun et au Nord Sénégal.
En Afrique de l’Ouest, le sorgho est principalement cultivé dans la zone de climat sahélien comprise entre les isohyètes 400 et 1200 mm (figure 2). Ce climat est caractérisé par l’alternance de deux saisons, l’une totalement sèche dont la durée va de 5 à 8 mois du sud au Nord, l’autre humide avec un régime de précipitations de type mousson tropicale. La date de début de la saison des pluies est très variable d’une année sur l’autre, mais en revanche sa durée est bien corrélée à sa date d’occurrence: une saison qui débute précocement dure longtemps et inversement (Ouattara et al, 1998). D’autres facteurs écologiques sont également déterminants dans la production du sorgho et sont la température, le photopériodisme, l’eau, le sol et la fertilisation de même que les insectes et les plantes parasites.
GENERALITES SUR LES SYSTEMES RACINAIRES
Le système racinaire du sorgho
Le sorgho se caractérise par un système racinaire puissant qui explique en grande partie sa capacité à supporter des aléas importants en matière d’alimentation en eau. Il possède de nombreuses racines adventives qui s’enfoncent profondément dans la terre jusqu’à environ 110 à 200 cm. Les ramifications qu’elles émettent assurent l’exploration du sol dans toutes les directions (Chantereau et Nicou, 1991). Chez le sorgho, la croissance racinaire est active très tôt, dés que la première feuille perce le coléoptile par l’émission d’une racine séminale unique dont la longueur peut atteindre au stade deux feuilles jusqu’à 10 cm selon les variétés et selon les conditions de cultures (Chopart, 1980). Le système racinaire du sorgho a également la caractéristique de pouvoir supporter jusqu’à deux ou trois cycles culturaux à partir de simples repousses après avoir coupé les tiges.
Différences variétales du système racinaire du sorgho
Il existe des différences variétales chez le sorgho dans les comportements du système racinaire mais elles restent difficiles à étudier et donc à exploiter. Clerget (1999) a montré que la variété Sariaso 10 a une vitesse de croissance racinaire plus rapide soit 1,9 cm j -1 pendant le stade juvénile par rapport à Nazongala. Une bonne vitesse de croissance racinaire de départ représente un avantage important car elle permet un accès plus rapide aux ressources ce qui conduit à une meilleure tolérance à un déficit hydrique. Chopart (1980) montre aussi l’existence d’une différence variétale dans la colonisation du profil du sol par les racines. Ainsi la comparaison de deux variétés, Congossane et 63-18, fait apparaître que la première qui est de grande taille, possède un poids sec racinaire beaucoup plus important en profondeur témoignant d’une meilleure colonisation du sol.
Quelques mécanismes d’adaptation racinaire au déficit hydrique
En cas de déficit hydrique (manque d’eau par rapport aux besoins de la plante) la survie de la plante est assurée par sa capacité à exploiter les ressources hydrominérales du sol disponibles pour assurer son métabolisme. Cette aptitude est fortement liée aux caractéristiques racinaires de la plante, mais aussi à certains changements physiologiques au niveau de sa partie aérienne. Comme mécanisme d’adaptation physiologique au niveau de la partie aérienne, Sanchez Diaz et Kramer (1971) ont montré que la meilleure capacité d’adaptation au déficit hydrique du sorghopar rapport au maïs est liée à la forte capacité de rétention en eau de ses tissus.
En ce qui concerne le rôle des racines dans l’adaptation à la sécheresse, il faut d’abord comprendre, que l’eau et les éléments minéraux accèdent à la racine par diffusion dans le sol, sur une distance limitée (Maertens et al., 1974). Donc l’alimentation hydrominérale d’une plante dépend des caractéristiques racinaires de la plante, de celles du sol et de la nature de l’élément minéral considéré. Pour que les racines d’une plante puissent jouer pleinement leur rôle dans le processus d’alimentation hydrique et minérale, surtout lorsque le niveau de richesse minérale du sol est faible et la pluviométrie irrégulière comme c’est le cas dans les pays sahéliens, deux caractéristiques racinaires fondamentales sont à prendre en considération: Il s’agit de l’évolution du front racinaire au cours du cycle de la plante et du degré de colonisation du sol par les racines (Chopart, 1980). Le front racinaire correspond à la profondeur et à l’extension maximale d’enracinement. Il détermine le réservoir de sol utile pour la plante et le degré de colonisation se traduit par une augmentation de la biomasse racinaire, du volume racinaire et de la longueur racinaire (Chopart, 1980). Mc Pherson et Boyer (1977) montrent que chez le maïs le rapport masse aérienne /masse racinaire passe de 4 à 2,5 sous fort déficit hydrique pendant deux semaines avant la floraison. Les mesures de matières sèches ont montré une augmentation de la biomasse racinaire formée. Cette augmentation de la biomasse racinaire permet une meilleure exploration du sol et donc favorise un plus grand accès aux ressources (eau et éléments minéraux) permettant à la plante de mieux tolérer le déficit hydrique.
Le diamètre moyen des racines
L’évaluation des diamètres des racines permet également la caractérisation des systèmes racinaires. Elle permet des études comparatives, donne une idée sur le volume d’eau qui peut être véhiculé par les racines car la racine peut être considérée comme un puits. Mais l’utilisation de ce paramètre est très complexe du fait de la variabilité des diamètres au sein d’un système racinaire, et c’est souvent le diamètre moyen qui est pris en considération (Chopart, 1980). A partir du diamètre moyen il est également possible de déterminer le degré de ramification du système racinaire en calculant le coefficient de dispersion autour de la moyenne à l’aide d’une formule établie par (Maertens et al, 1974). Selon cette formule plus le coefficient de dispersion est élevé, plus lesystème racinaire est ramifié.
La surface racinaire
La mesure de la surface racinaire est aussi importante dans la caractérisation du système racinaire en ce sens qu’elle exprime la surface de contact avec le sol, et donc le niveau d’échange de la racine avec le milieu. Plus la surface de contact est grande, plus l’échange est important. Cependant, il faut aussi noter que la surface racinaire par rapport à la surface des grains de sol est très faible ce qui limite l’intérêt de l’utilisation de ce paramètre pour des études de bilan hydrique (Chopart, 1980).
Le front racinaire
L’estimation du front racinaire vertical et horizontal revêt aussi une grande importance. La connaissance de la position des racines les plus profondes à un moment donné, présente un intérêt majeur pour dimensionner le volume de sol utile pour l’alimentation de la plante. Sa détermination est très difficile sur le terrain car il faut excaver de très grands volumes de sol. Une estimation de cette caractéristique racinaire a été réalisée pour le mil au Sénégal où le front racinaire atteint jusqu’à 2 m de profondeur (Chopart, 1980).
Relation entre le système souterrain et aérien dans l’adaptation à la sécheresse
Dans les mécanismes d’adaptation des plantes à la sécheresse, il existe également une relation étroite entre les racines et la partie aérienne de la plante dans la régulation des pertes en eau qu’il est important de souligner. En effet, les racines de la plante déclenchent la production d’acides abscissiques lorsque l’eau commence à devenir limitante dans son environnement. Cette substance provoque la fermeture des stomates conduisant à une baisse de la transpiration et donc à la réduction des pertes en eau (Fabre et al., 2004).