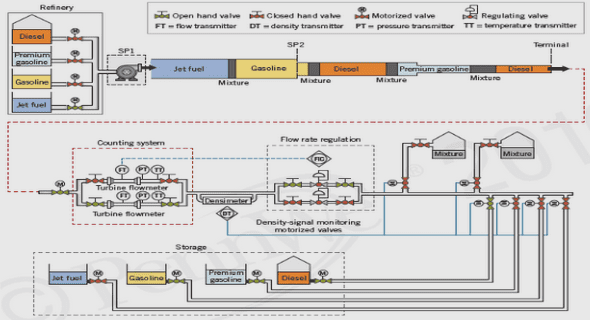
Nitrification
La nitrification est un procédé aérobie d’oxydation réalisé par des micro-organismes autotrophes utilisant l’ammoniaque (NH3) comme source d’énergie, le CO2 comme source de carbone et l’oxygène (O2) comme source d’oxydant (Prosser, 1990). L’ammonium (NH4 + ) étant en équilibre avec le NH3 dissout (Zaman et al., 2008), on considère NH4 + comme étant la source de la nitrification. Dans les sols, les conditions requises pour garantir la mise en place de ce processus sont une teneur en eau assez faible pour permettre une bonne circulation de l’air, et donc de l’O2, tout en garantissant une bonne circulation à la fois des micro-organismes nitrifiants et des substrats N et C dans le sol, une teneur en NH4 + suffisante et une activité bactérienne et racinaire permettant la production de CO2. Le N2O est en fait un coproduit de la nitrification, le produit final étant NO3 – si la réaction est complète (Fig 1.1). Néanmoins, certains micro-organismes nitrifiants sont aussi capables d’effectuer une dénitrification à faible pression partielle d’O2 à la suite d’une nitrification et ainsi produire du N2O par ce biais (ButterbachBahl et al., 2013) (Fig. 1.1).
Dénitrification
A l’inverse de la nitrification, la dénitrification est un procédé de réduction en milieu anaérobie (absence d’O2) réalisé par des micro-organismes hétérotrophes utilisant le carbone organique du sol comme source d’énergie et de carbone et le NO3 – et ses dérivés (c’est-à-dire le nitrite (NO2 – ), le monoxyde d’azote (NO) et le N2O) comme oxydants (Knowles, 1982) (Fig 1.1). Le N2O est un produit intermédiaire de la dénitrification, le produit final étant le N2 si la réaction est complète (lorsqu’un sol est saturé en eau par exemple).
Les raisons pour lesquelles la dénitrification n’a pas lieu en milieu aérobie sont multiples : dans le cas des micro-organismes capables d’utiliser à la fois l’O2 et les dérivées des nitrates comme accepteur d’électrons, ceux-ci auront une préférence pour l’utilisation de l’O2 puisque le pouvoir d’oxydation de celui-ci est supérieur à celui des dérivés du NO3 – . Pour le cas des micro-organismes utilisant uniquement les dérivés du NO3 – comme oxydants, la présence d’O2 inhibe la chaîne de transport d’électrons des enzymes responsables de la réduction des dérivés du NO3 -, c’est-à-dire les NO3 – , NO2 – , NO et N2O réductases, au sein de ces micro-organismes et les empêchent ainsi d’effectuer une dénitrification (Satyanarayana et al., 2012).
Les nombreux processus impliqués dans la formation et l’émission de N2O sont fortement influencés par l’état bio-physico-chimiques de leur environnement (pH, nature du sol, contenu en eau, contenu en C et N, …) (Knowles, 1982 ; Senbayram, 2012). Par exemple, certaines études ont montré que la faible teneur en cuivre (Cu) des sols bloque la dernière étape de la dénitrification transformant le N2O en N2, même en milieu anaérobie (Felgate et al., 2012 ; Sullivan et al., 2013) : en effet, l’enzyme NosZ responsable de cette réaction finale contient un groupe d’atome de la forme Cu4S2. Sans une teneur suffisante en Cu dissout dans le milieu, l’enzyme n’est plus synthétisée et la dénitrification n’est pas totale, conduisant donc à la présence de N2O dans le milieu.
En comparaison à la nitrification, la dénitrification est majoritairement reconnue comme étant le principal processus responsable de la formation du N2O des sols (Khalil et al., 2004).
Facteurs d’influence des émissions de N2O
Les facteurs d’influence biotique et abiotique de la production et de l’émission de N2O vers l’atmosphère sont multiples et complexes, ceux-ci interagissant les uns avec les autres. Le schéma de Robertson (1989) permet de rendre compte de cette complexité dont les facteurs les plus importants seront détaillés par la suite (Fig 1.2). . Teneur en azote La présence d’azote dans les sols sous forme minérale, NH4 + et NO3 – , est primordiale dans la production de N2O car ces composés sont les substrats à l’origine des processus de nitrification et de dénitrification. Ceux-ci sont naturellement présents dans le sol à des teneurs variables selon le contenu en matière organique (feuilles, racines, animaux morts…) et du potentiel de décomposition par les différents organismes du sol. La présence et la teneur de ces composés dans le sol sont fortement influencés par le climat, le type de sol et la végétation qui les prélèvent pour leur croissance (Fig 1.2). L’augmentation de la concentration en NH4 + du sol entraine une augmentation de la concentration en NO3 – lorsque les conditions de nitrification sont réunis, ce qui peut faire ensuite augmenter la production en N2O dans des conditions favorables. Ainsi, Morril et Dawson (1967) dans leur étude sur 3 types de sol prélevés sur des sites agricoles aux alentours de New York ont montré qu’un apport d’une solution de NH4 + dans le sol augmente la teneur en NO3 – du sol au cours du temps via la nitrification (Fig 1.3). Stevens et Laughlin (1994) ont établi dans leur expérimentation en laboratoire que la quantité de N2O produit par dénitrification augmente avec la teneur en NO3 – (Fig. 1.4). Néanmoins, une trop forte concentration en NH4 + entraîne une diminution du pH du sol qui peut entraîner une inhibition de la nitrification (Dancer et al., 1973).
Disponibilité en matière organique
La matière organique du sol joue un rôle crucial dans la production de N2O car elle apporte aux micro-organismes responsables les substrats N et C nécessaires à leur activité (Knowles, 1982) dont la disponibilité varie selon leur état de minéralisation. Si la production de N2O dans un sol augmente avec la quantité de matière organique disponible dans le sol (Qiu et al., 2015), elle varie également en fonction sa qualité. Millar et Maggs (2004) ont montré dans leur étude en laboratoire sur des prélèvements de plantes et de sols au Kenya incubés dans les mêmes conditions que la production et les émissions de N2O variaient en fonction de l’espèce de plante dont les résidus sont apportés au sol (Fig 1.5. a.). Cette production/émission est négativement corrélé à la composition en lignine et polyphénol (matières organiques difficilement décomposable) des résidus (Fig 1.5. b.). Elles varient aussi négativement et linéairement avec l’augmentation du rapport C/N de la matière organique (Huang et al., 2004).
Teneur en eau et propriétés pédologiques du sol
Le contenu en eau du sol et le type de sol (granulométrie, texture, porosité…) contrôlent à la fois la diffusion de l’O2, des substrats carbonés et azotés et celle du N2O (Fig. 1.2). Le processus de dénitrification est fortement contraint par la teneur en O2 du sol. Plus la teneur en O2 est élevée, moins l’activité de dénitrification est importante (Fig. 1.6). Un contenu en eau du sol élevé favorise donc le processus de dénitrification, et donc la production de N2O, en limitant la diffusion de l’O2 dans le sol. Néanmoins, cela réduit aussi la diffusion du N2O vers l’atmosphère (Linn et Doran, 1984 ; Ball et al., 2013). L’indicateur le plus couramment utilisé pour estimer l’aération d’un sol est le WFPS (Water Filled-Pore Space, espaces interstitiels remplis d’eau, en %). Ce paramètre tient compte de la quantité d’eau présente dans le sol et de la porosité du sol et est définie comme : 𝑊𝐹𝑃𝑆 = 100 ∗ 𝐻𝑣 1− 𝑑𝑎 𝑑𝑟 (1) avec 𝐻𝑣 l’humidité volumique du sol (%), 𝑑𝑎 la densité apparente (kg m-3 ) et 𝑑𝑟 la densité réelle du sol (kg m-3 ).
La nitrification et la dénitrification sont fortement corrélées avec le WFPS. D’après la littérature, pour des climats tempérés la nitrification augmente linéairement avec la teneur en eau du sol jusqu’à une valeur seuil de WFPS à 60% (Fig. 1.6, Linn and Doran, 1984 ; Parton et al., 1996). A l’inverse, la dénitrification est active à partir d’un WFPS à 62% avec un optimum situé entre 70 et 80% (Linn and Doran, 1984 ; Hénault et al., 2005 et Fléchard et al., 2007). a) b)
Fig. 1.5. Emissions de N2O journalières suivant l’addition de différentes espèces de résidus au sol (a) et corrélation entre le cumul de N2O (mgN m-2 ) émis après 29 jours d’après l’étude de Millar et Baggs (2004) (symbole plein) et émis pendant 23 jours d’après l’étude de Baggs et al. (2001) (symbole vide) suivant l’ajout de résidus et le ratio (lignine%+polyphénols%)- sur-N% des résidus (b). Illustration d’après Millar et Baggs (2004). Néanmoins, ces seuils théoriques ont été établis à partir d’analyses faites sur des sols de régions tempérés et peuvent donc varier selon les sols et les climats.
Les émissions de N2O depuis le sol vers l’atmosphère dépendent à la fois de sa concentration dans le sol, et donc de sa production, mais aussi de son transport vers l’atmosphère. La diffusion moléculaire du N2O vers l’atmosphère dépend de sa capacité à se diffuser dans l’air et des propriétés physiques du sol comme sa structure et son contenu en eau (Allaire et al., 2008, Maier et al., 2017). De ce fait, les émissions seront optimales si la quantité d’eau dans le sol est suffisante pour réduire la concentration en O2 mais assez faible pour permettre la diffusion du N2O vers la surface. Ainsi, Rabot et al. (2016) ont observé qu’un contenu en eau du sol élevé est favorable à la production de N2O par dénitrification mais défavorable à sa diffusion vers l’atmosphère, un sol humide à tendance à bloquer le N2O dans le sol. Néanmoins dès que celuici s’assèche, on peut noter un important pic d’émission une fois que le potentiel d’arrivé d’air est atteint, pic qui est d’autant plus fort que la durée de blocage est grande. Il peut donc exister un décalage temporel entre le moment où les conditions nécessaires à la production de N2O sont réunies et le moment où l’on peut mesurer son émission (Molodovskaya et al., 2012). L’humidité du sol joue également un rôle dans le contrôle de l’activité des microorganismes en modulant leur déplacement ainsi que la diffusion des substrats C et N dont elles ont besoin. Rétroactivement, une activité microbienne et racinaire suffisamment stimulée peut entraîner une consommation importante de l’O2 du sol et conduire à la formation de microsites anaérobies favorisant la dénitrification, et donc la production de N2O (Castaldi, 2000).
Le contenu en eau du sol et son temps de rétention sont fortement conditionnés par la texture du sol. Un sol à texture fine, i.e. à forte teneur en argile, présente des capacités de rétention de l’eau, donc de l’abaissement de la teneur en O2 (potentiel redox plus faible), plus élevé qu’un sol sableux. Cette propriété confère aux sols argileux un potentiel de dénitrification plus élevé que celui de sols grossiers (Bouwman et al., 2002). Charles et al. (2017) ont montré dans leur méta-analyse sur plus de 38 études réparties sur 12 pays que les facteurs d’émissions des sols à texture fine sont en moyennes 2.8 fois plus importants que pour les sols à texture grossière. Ainsi, si le contenu en N d’un engrais organique est supérieur à 10 % de la masse sèche totale, les sols à texture fine ont un facteur d’émission de N2O supérieur aux sols à texture grossière (Fig. 1.7).
Température
La température a un impact direct sur l’activité biologique du sol. En effet, la respiration du sol augmente avec la température d’après l’équation d’Arrhenius suivant une loi exponentielle croissante (Lloyd and Taylor, 1994) et entraine de ce fait une forte consommation de l’O2 du Fig. 1.7. Variation du facteur d’émission de N2O en fonction du contenu en N minéral d’engrais organiques seuls ou combinés à des engrais de synthèse et de la texture du sol. Illustration d’après Charles et al. (2017). sol et donc la formation de zones anaérobies favorables à la dénitrification (Smith et al., 2003). Les micro-organismes nitrifiants sont fortement impactés par la température et ont une activité optimale entre 20 et 40 °C (Shammas, 1986 et Stark, 1996). Les micro-organismes dénitrifiants seraient plus impactés par les variations du contenu en eau du sol que par les variations de température du sol (Szukics et al., 2010). Néanmoins, les impacts de la température sur la production/émission de N2O sont très incertains. Plusieurs études en laboratoire réalisées avec des prélèvements de sols provenant de forêts tempérées des Etats-Unis et de Chine montrent que les émissions de N2O augmentent avec la température (Smith et al., 1997 ; Wertz et al., 2012 ; Zhang et al., 2019) avec un optimum d’émission compris entre 25 et 35 °C (Dobbie and Smith, 2001) alors que Qin et al. (2012) ont montré une très faible corrélation entre les émissions de N2O vers la surface et la température lors d’une étude menée sur un site agricole expérimental dans le nord de la Chine (R² = 0.08). Bureau (2017) a également mis en évidence l’absence d’effet significatif de la température sur les émissions de N2O dans une étude menée en laboratoire avec des prélèvements de sols issus d’un site agricole dans le centre de la France et incubés en laboratoire dans un environnement contrôlé. L’effet de la température sur les flux est donc très variable d’une étude à l’autre. Ceci peut s’expliquer par le fait qu’il affecte à la fois l’activité bactérienne du sol (Butterbach-Bahl et al., 2013), et donc la production mais aussi la consommation du N2O, et la diffusion des gaz qui augmentent avec la température (Pritchard et Currie, 1982 ; Massman, 1998).
pH
Le pH du sol a un effet important sur la nitrification et la dénitrification : l’activité des micro-organismes nitrifiants diminuent à des pH faibles et élevés avec un optimum entre 5 et 7.8 dépendant du site d’étude (Bramley et White, 1990 ; Antoniou et al., 1990) alors que dans le cas de la dénitrification, il semble qu’il n’existe pas de véritable optimum de potentiel de dénitrification. En effet, Šimek et al. (2001), dans leur étude en incubation en laboratoire de prélèvements de sol issus de différents sites agricoles ou montagneux de Tchéquie, ont montré que l’effet de la variation du pH sur l’activité enzymatique des micro-organismes dénitrifiants d’un sol dépendait surtout du pH initial du sol avant variation. L’activité enzymatique sera donc fonction de la capacité des communautés initialement présentes à s’adapter aux nouvelles conditions, une période d’incubation longue entraînant un changement d’espèces dominantes de dénitrifiants dans le milieu et donc une modification de la réponse à une variation de pH. Ils ont néanmoins montré qu’à un pH supérieur à 7, le rapport N2O/N2 diminue en faveur du N2, la dénitrification étant complète. Ce résultat est cohérent avec ceux d’autres études qui ont montré que le pH a surtout un effet sur la dernière étape de la dénitrification (réduction du N2O en N2). En effet, l’enzyme responsable de cette dernière étape (la N2O-réductase) est inhibée en milieu acide (pH <5) (Cuhel et al., 2009) où les émissions de N2O dépassent celles du N2, une dénitrification complète étant plus difficile, ce ratio diminuant avec l’augmentation du pH (Struwe and Kjøller, 1994 ; Van Den Heuvel, 2011).
Transport du N2O par les plantes
Le N2O, au même titre que le méthane, peut aussi être transporté passivement par les tiges et les tissus des plantes, comme cela peut être observé pour le CH4 (Rusch and Rennenberg, 1998). Cette voie de transport est généralement négligée dans les estimations des émissions de N2O mesurées ou modélisées mais plusieurs études ont montré qu’elle pouvait néanmoins être significative (Machacova et al., 2016). Cette voie de transport serait d’autant plus élevée dans les forêts aux sols humides par rapport à des sols plus secs (Machacova et al., 2016). Dans une étude de Wen et al. (2016a) menée sur une forêt allemande, les émissions mesurées directement à la surface des épicéas et des hêtres représentaient entre 8 et 11 % des émissions totales de la forêt. Ce rapport peut-être d’autant plus grand sur des zones entièrement inondées comme les rizières où les émissions via les plantes de riz peuvent atteindre 80% du total des émissions (Yu et al., 1997).
Influx de N2O
Des influx de N2O de l’atmosphère vers les sols (consommation de N2O) sont aussi possibles mais dans la majeure partie des cas, on observe plutôt des efflux de N2O (production et émission) vers l’atmosphère. Néanmoins, Wu et al. (2013) ont observé sur un site montagneux en Chine une consommation de N2O dans le sol la majeure partie de l’année. Ce phénomène est dû à une transformation du N2O présent à la surface en N2 dans des conditions favorables à la dénitrification (Wen et al., 2016b ; Hu et al., 2015). Cependant, Wu et al. (2013) ont aussi identifié et mesuré ce phénomène dans des conditions aérobies pourtant défavorables à la dénitrification, mettant en avant le fait que ce processus pourrait ne pas être l’unique explication.