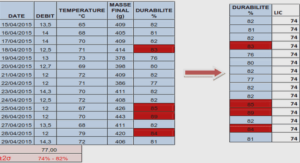
Présentation de la réaction d’addition de Michael
Définition et historique
Arthur Michael, né le 7 août 1853 est un chimiste organicien américain, connu pour les réactions d’addition de Michael. Né dans une famille aisée de Buffalo, Arthur Michael est le fils d’investisseur immobilier, John et Clara Michael. Il étudie d’abord au sein du laboratoire d’ Hofmann à l’université de Berlin puis deux ans auprès de Robert Bunsen à l’université de Heidelberg avant de revenir auprès d’Hofmann. Il étudie alors une autre année avec Wurtz à l’école de médecine de Paris et avec Dimitri Mendeleïev à Saint-Pétersbourg. Retournant aux Etats-Unis en 1880, Michael devient professeur de chimie à l’université de Tufts où il enseigne de 1882 à 1889.
En 1912, il enseigne la chimie à l’université Harvard jusqu’à son départ à la retraite en 1936. Arthur Michael décède à Orlando le 8 février 1942. Il est principalement connu de nos jours pour l’addition de Michael aussi nommée réaction de Michael. L’addition ou réaction de Michael est une réaction qui permet la création de liaison carbone-carbone voire carbone-soufre nommée sulfa-Michael, carbone-azote nommée aza-Michael ou carboneoxygène nommée oxo-Michael. Cette réaction, le plus souvent catalysée par une base (ou un agent de transfert de phase), nécessite deux partenaires de synthèse, un donneur et un accepteur de Michael. Michael l’a définie initialement comme la réaction de condensation d’un ion énolate sur un composé carbonylé α-β insaturé (aldéhyde, cétone et même ester α, β insaturé) [W2].
En 1887, Komnenos a découvert le premier exemple d’un nucléophile de carbone ajoutant à une double liaison carbone-carbone déficient en électron en observant l’addition facile de l’anion de malonate de diéthyle en malonate d’éthylidène [17]. Quatre ans après, Arthur Michael a systématiquement étudié les réactions de divers anions stabilisés avec des systèmes α, β insaturés comme par exemple l’addition conjuguée de malonate de diéthyle (2) à la double liaison du cinnamate d’éthyle (1) en présence d’éthanolate de sodium pour fournir un diester d’acide pentanedioïque (3) substitué (schéma 8) [18].
Accepteurs de Michael
La réaction d’addition 1,4 de Michael sur les oléfines activés, est l’une des méthodes très utilisée pour la formation de liaisons carbone-carbone, carbone-hétéroatome en synthèse organique. Ces oléfines sont des composés possédant un groupe électroattracteur (nitrile, nitro, cétone ou ester) conjugué avec une double liaison. Il est généralement sous la forme suivante (figure 1). GEA : groupe électroattracteur R : groupe électroattracteur ou électrodonneur Figure 1: structure d’un accepteur de Michael La réactivité des accepteurs de Michael peut être modifiée de telle sorte que l’addition-1,4 serait contournée en faveur de la position α d’un système α, β insaturé.
Ceci est connu comme étant la réaction anti-Michael, réaction de Michael anormale ou substitution du carbone α. La régiosélectivité de la réaction de Michael peut être inversée par des groupes ayant des propriétés fortement électroattractrices à la position β et la réaction donne le produit d’addition en α (schéma 9). Mais aussi dans certaines contraintes, plus précisément dans les réactions sous contrôle de charge en synthèse organique, le nucléophile peut s’additionner directement sur le carbone fonctionnel, connu sous le nom d’addition 1,2 [19].
L’étude théorique des facteurs contrôlant la régiochimie de l’addition de Michael ou addition nucléophile au carbone β par rapport au carbone α des accepteurs substitués à la position 4, montre que cela dépend de la nature des substituants. Les groupes électrodonneurs par augmentation de la densité électronique du coefficient de l’orbitale p en valeur absolue et de la diminution de l’énergie de l’atome β, favorisent l’addition normale tandis que la présence des groupes attracteurs d’électrons stabilisent la réaction vers l’addition anormale en augmentant le coefficient du carbone α (schéma 10)