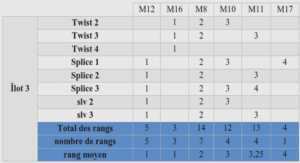
NOTION D’ECHELLE DANS LES METHODES SEPARATIVES
La figure 1 montre la séparation électrocinétique capillaire d’un mélange de catéchols et de catécholamines (voir formules en Annexe) en milieu tampon phosphate, à pH 7. Préciser le mécanisme de cette séparation et interpréter l’ordre de migration. La durée de l’analyse peut être très sensiblement diminuée en opérant au même pH, mais en milieu borate (figure 2). L’ordre de migration est alors profondément modifié. Interpréter, sachant que les ions borate donnent, avec les composés a-hydroxylés, des complexes de la forme :Séparation des neutres entre eux par interaction hydrophobes Micelle anionique donc séparation des chargés +1 par interaction électrostatique et hydrophobe Incidence de la charge sur l’ordre de sortie tm neutre < tm chargé +1 Normal car les chargés +1 interagissent avec les micelles anioniques donc plus retenus Pour les neutres : Interactions hydrophobes Séparation suivant l’hydrophobie croissante donc indice de Rekker Log Poctanol/eau = ∑fi donc décomposer la molécule en différent morceaux Plus le log P augmente, plus la molécule est hydrophobe. Partie commune du catéchol log P0Ordre attendu En résumé, priorité à la charge globale et ensuite hydrophobicité.
Tampon phosphate – borate pH 7 avec SDS : Ordre modifié et tr bien diminuée. Changement de charge : Composés 1 – 4 sont devenus neutre et composés 5 – 7 chargé négativement Inversion des familles. 1 – 4 : Hydrophobie rentre en jeu, plus d’interaction électrostatique. 5 – 7 : Plus d’attraction électrostatique (répulsion avec les micelles donc pas d’inclusion) 1 – 2 – 3 – 4 : ordre d’hydrophobie (Rekker) donc ordre attendu 5 – 7 – 6 : composés chargés, se séparent par différence de mobilité (taille) Tampon borate pH 7 sans SDS : On attend : • Absence de séparation des composés neutres 1 – 4 • Séparation des 3 autres comme précédemment (taille) Séparation 5 – 7 – 6 : On a bien CAT < MC < L-DOPA par différence de taille Rappel : Mode contre-électroosmotique donc les plus mobiles sont détectés en dernier Séparation 1 – 4 : Ils sont neutres donc ne doivent pas être séparés mais on les distingue un peu. Complexation non total dans le borate donc amorce de séparation (4 puis 3 puis 2 puis 1).La figure 1 représente une séparation électrocinétique de purines substituées dans un tube capillaire en silice fondue de 1 m de longueur et 75 mm de diamètre intérieur. La tension appliquée est de 17,5 kV. L’ électrolyte est constitué de Na2HPO4 10 mM, Na2B4O7 6 mM et de SDS 50 mM. L’ échantillon est mis en solution dans l’ électrolyte et est introduit par électromigration à l’ extrémité du capillaire relié au pôle positif. La détection est effectuée par absorptiométrie UV à 280 nm, directement à travers le capillaire, à 90 cm de l’ extrémité par laquelle l’ échantillon est injecté.
Calculer le pH de l’électrolyte (on remarquera que Na2B4O7 est un mélange d’acide borique et de borate de sodium) 2NaBO2 + B2O3 = 2HBO2 – H2O Constantes acido-basiques : H3PO4 : pk1 = 12,4 ; pk2 = 7,2 ; pk3 = 2,1 HBO2 : pk = 9,2 2/. Dans l’eau, les purines étudiées ont des propriétés basiques extrêmement faibles et ne sont protonables qu’en milieu très acide. A l’ exception de la cafféine, elles présentent en revanche, suivant les espèces, une ou deux fonctions acides, dont les constantes sont données dans le tableau I. a/. Etablir, pour un monoacide HA de constante k, puis pour un diacide H2A de constantes k1 et k2, l’expression de la charge apparente en fonction du pH de l’électrolyte. Déterminer la charge apparente au pH de l’électrolyte pour chaque purine. b/. Interpréter l’ordre de migration et indiquer le mécanisme de séparation dominant. En quel rang sortirait la caféine en absence de SDS ? Comment peut-on expliquer le comportement du couple acide urique-xanthine ?Les micelles sont anioniques donc chargées négativement Les composés sont chargés négativement aussi
Donc les micelles ne peuvent pas apporter grand-chose à la séparation. Séparation électrophorétique suivant la différence de charge et de taille des molécules. Les masses sont très proches (136 à 180) donc à priori la charge a plus d’importance que la masse. Pour les composés A, B et C : A pH 9,2, le composé C est le plus chargé et le composé A le moins chargé (car pk = 8,6) Donc comme on est en mode contre électroosmotique, les anions sortent du moins mobile au plus mobile Donc A – B – C Composé D : Neutre donc sort normalement en premier avec le flux EOF, mais il peut être solubilisé dans les micelles et donc sortir avec un temps de rétention. Donc en retard. Sans SDS, le composé D sort avec le flux EOF. Composé E – F : Inversion par rapport à la charge apparente (1,05 pour E et 1,00 pour F) La différence de n est très faible (0,05). Toute approximation a donc une grande importance. Ceci peut s’expliquer par une approximation sur la valeur des pk. Du coup, il faut prendre la masse de la mosécule en compte. E + lourd que F Donc compromis entre les deux et dans ce cas, c’est la masse qui « gagne ».