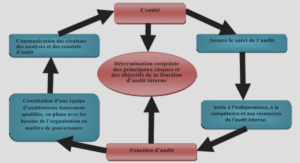
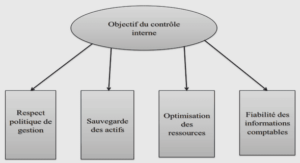
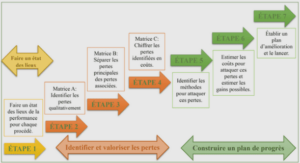
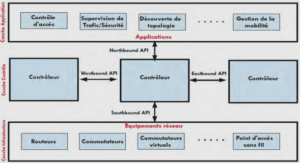
Formation moteur flagellaire, ablation laser et stabilisation laser, tutoriel & guide de travaux pratiques en pdf.
Assemblage du filament
Crochet
Le corps du moteur flagellaire comprend une machine exportatrice de protéines spécifiques au filament [13]. Ce système de sécrétion, que les biologistes désignent comme “système de sécrétion de type III”,exporte la plupart des composantes extra-cellulaires requises pour la construction du crochet et le filament à l’aide de la force proton motive (proton motive force, PMF).
Une fois que le corps du moteur ainsi que la partie rotative du moteur (appelée rod) sont construits, le système de sécrétion ajoute les sous-unités formant le crochet, soit des protéines FlgE. Le crochet se développe ensuite jusqu’à une longueur de 55 nm. Deux protéines sont impliquées dans la mesure très précise de la longueur du crochet : FliK et FlhB [16] 1. L’ab-sence de FliK provoque la formation de longs polyhooks sans filaments (crochets pouvant aller jusqu’à 1 µm [17]) tandis que l’absence de FlhB forme un complexe polyhook-filament. Ceci indique que le changement du type de substrat exprimé marquant le début de l’assemblage du filament peut se faire sans FlhB mais avec une synchronisation déficiente [16]. FliK agit comme une règle moléculaire mesurant directement dans le temps la longueur du crochet.
L’interaction entre FliK et FlhB une fois la longueur voulue atteinte catalyse la réaction né-cessaire au changement de sécrétion de substrats de type filament [17]. Ce changement de substrat provoque le début de l’assemblage du filament.
Protéines associées au crochet (hook-associated proteins, HAP)
La sécrétion de ces protéines régulatrices ainsi que l’achèvement de la construction du crochet provoque un changement dans la spécificité du système de sécrétion de type III. En effet, lorsque le complexe crochet-corps est complété, la sécrétion de substrats de type filament est engagée. Une fois ce changement activé, la protéine FlgM est sécrétée libérant ainsi 28 pour activer la transcription du promoteur de Classe 3. Les gènes entraînant la production du reste du filament ainsi que du système de chimiotaxie sont alors activés [18].
Cependant, avant de pouvoir faire grandir le filament, trois types de protéines doivent être sécrétées. Ces protéines associées au crochet (HAP) sont nécessaires pour que la construction du filament se produise. En premier lieu, La protéine FlgK vient se lier au crochet pour former la première partie d’un adaptateur entre le crochet et le filament. La protéine FlgL est ensuite exportée permettant finalement à la protéine FliD, aussi appelée cap, de prendre place [19]. Cette structure est composée de 5 copies de FliD et est essentielle à la croissance du filament étant nécessaire pour la polymérisation des unités de FliC du filament [20, 21]. Lors de l’assemblage du filament, le cap se trouve donc au bout de celui-ci.
Construction du filament
Le filament flagellaire est formé de plusieurs milliers de sous-unités de flagelline (FliC) et il peut atteindre entre 10 et 15 µm. Pour ce faire, les sous-unités sont produites dans la cellules et sont exportées dépliées hors de la cellule par un mince canal à l’intérieur du filament. Une fois arrivée au bout, le cap polymérise et met en place les sous-unitées [22, 23].
Bris d’un filament
La présence des trois HAPs étant nécessaire à l’assemblage du filament, un filament cassé doit donc former un nouveau cap pour que la croissance puisse se poursuivre. L’absence du cap inhibe l’assemblage du filament [20, 21]. Cependant, pour qu’il puisse se former, il doit pouvoir se lier aux protéines FlgL lors de l’assemblage du filament. Comme FlgL n’est pas présente dans le filament [19], un cap doit pouvoir se former sans la présence de FlgL lors d’un bris. Ces trois protéines sont cependant constamment sécrétées durant l’assemblage du filament et rejetées à l’extérieur par le cap sans être intégrées au filament [24], ce qui pourrait potentiellement permettre la reprise de la croissance. Les expériences du chapitre 2 utilisent l’ablation laser pour briser des filaments et observer si le ceux-ci continuent de s’assembler ou non.
Figure 1.3 – Exemple de marquage fluorescent. On peut voir 2 marquages différents, un orange et un vert. Le premier (orange, 546 nm) est un marquage réalisé sur la culture au complet. Une fois que les bactéries sont fixées sur la lamelle de microscope, une deuxième période de croissance d’une durée d’une heure a été réalisée ainsi qu’un deuxième marquage (vert, 488 nm). Certains corps de bactéries peuvent être partiellement marqués. Les corps les plus lumineux sont des bactéries mortes la majorité du temps.
Visualisation du filament
Le filament bactérien n’est pas visible à l’aide de la microscopie optique traditionnelle, nous devons utiliser d’autres façons pour le visualiser. La façon la plus simple pour visualiser le filament en entier de bactéries in vivo est par fluorescence. Pour éviter de marquer la membrane de la cellule, ce qui noierait le faible signal produit par les filaments, un marquage spécifique de ceux-ci est nécessaire.
La méthode utilisée pour obtenir un marquage ciblé requiert la modification de la protéine FliC. Celle-ci est modifiée pour remplacer un acide aminé de la chaîne par une cystéine dans la protéine (Voir sections 2.7.1 et le tableau 2.2 pour plus de détails sur les différentes souches utilisées durant les expériences de fluorescence). L’acide aminé spécifique qui est remplacé par une cystéine est choisi pour que celui-ci soit accessible du milieu ambiant lorsque la protéine est polymérisée. Il existe plusieurs endroit sur la chaîne d’acides aminés donnant de bons résultats, mais pour ces expériences, nous avons utilisé des souches où la tyrosine 237 a été remplacée par une cystéine(FliC 237 ).
Les fluorophores utilisées (Alexa-Fluor C5-maléimide, Invitrogen) ont un groupe maléimide qui réagit avec le groupe thiol de la cystéine. Ceci nous permet d’obtenir un marquage très ciblé des filaments avec des bactéries toujours vivantes. Ils sont de plus disponibles dans un grand éventail de longueurs d’onde.
Les expériences décrites au chapitre 3 ont pour but de mesurer le taux de croissance du filament bactérien. Pour ce faire, les bactéries sont soumises à différentes périodes de croissance de durées précises. En alternant les longueurs d’onde des fluorophores utilisés pour marquer les filaments durant ces multiples périodes de croissance, nous obtenons des filaments marqués de 1, 2 ou 3 couleurs permettant d’obtenir un taux de croissance du filament en fonction de sa longueur initiale. Une exemple de double marquage est montré à la figure 1.3.
Ablation laser
Les lasers sont des sources cohérentes de rayonnement optique pouvant générer beaucoup de lumière et pouvant être manipulées et fortement focalisées dans l’espace. En concentrant un faisceau dans un petit volume, il est possible d’obtenir une grande quantité d’énergie en un point précis. Les lasers sont donc utilisés dans de nombreuses applications pour modifier des matériaux et tissus (chirurgie oculaire, soudure, écriture de guide d’onde, etc.). L’utilisation de ces outils permet une flexibilité et un contrôle incroyable considérant la facilité avec laquelle on peut manipuler les faisceaux. Le dommage créé par un faisceau laser résulte généralement d’une élévation locale de la température du matériau.
Lorsque des tissus biologiques sont utilisés, l’utilisation de laser est très utile car le faisceau peut facilement être concentré en un point sous le micromètre lorsqu’un objectif à haute ouverture numérique est utilisé. Cependant, comme les structures biologiques sont petites et souvent très denses, les chercheurs ont dû développer des outils résultant en un dommage localisé amenant le minimum de dommages collatéraux. Par exemple, une façon d’étudier la fonction d’une cellule dans l’organisme C. elegans est de tuer cette cellule et d’observer le développement de l’organisme. L’élimination d’une neurone nous informe donc sur sa fonction dans l’organisme, soit la mobilité, se nourrir ou la sensibilité à son environnement [25]. Une technologie récente est utilisée pour obtenir ces résultats, le laser à impulsions ultra-brèves. La nature du dommage est intimement relié à la durée des impulsions ainsi qu’au taux de répétition. La durée des impulsions du laser utilisé pour les expériences de cette thèse est quelques dizaines de femtosecondes. Ce type de laser donne un dommage très local et produit très peu de chaleur, deux raisons importantes justifiant son utilisation. Les principes physiques à l’origine de la création de ce dommage est abordée dans cette section.
Mécanismes physiques provoquant des dommages
Le domaine de l’ablation laser à impulsions ultra-brèves est un sujet riche et très vaste [26, 27, 28, 29]. Cette section sera donc un bref résumé sur la façon dont le dommage est créé.
Formation d’un plasma
Pour obtenir du dommage reproductible et localisé, un seuil d’éclairement énergétique (SEE) doit être atteint pour qu’un claquage optique 2 soit obtenu. Le SEE des tissus biologiques est très similaire à l’eau [27] et cette approximation sera utilisée ici. La figure 1.4 montre le processus de photo-ionisation multi-photonique qui débute la formation du plasma. Ce processus produit des électrons quasi-libres (qu’on appellera électrons libres par la suite). L’ionisation d’un électron dépend du milieux où se fait l’ablation (ici l’eau) et la longueur d’onde utilisée [27]. Le modèle accepté dicte que la photo-ionisation est proportionnelle à Figure 1.4 – Processus d’ionisation multi-photonique entraînant une avalanche d’électons. Lorsqu’un électron est excité jusqu’au potentiel d’ionisation, il absorbe l’énergie d’autres pho-tons jusqu’au seuil représenté par la ligne pointillée (absorption par bremsstrahlung inverse) ; celui-ci obtient alors l’énergie nécessaire pour en exciter un autre. Ce processus se répète pour créer l’avalanche d’électrons libres. Figure tirée de [27] , où est l’irradiance [W/cm2] et k le nombre de photons nécessaire pour franchir la bande interdite de l’eau [27, 28]. Comme la largeur de bande interdite de l’eau est de 6.5 eV, équivalent à 5 fois l’énergie d’un photon de 800 nm, k vaut 5 pour notre montage [30]. Une fois ionisés, les électrons absorbent par processus de Bremsstrahlung inverse l’énergie d’autres photons jusqu’à un seuil leur permettant d’exciter d’autres électrons. L’accumulation de ces étapes provoque une avalanche d’électrons libres tout au long de l’impulsion laser créant ainsi un plasma.
Claquage optique
Lorsqu’une densité critique d’électrons libres est atteinte, un plasma est créé. On parle ici du phénomène de claquage optique. Selon Vogel et al [27], le SEE provoquant un claquage optique mène à la création d’une densité d’électrons libres critique = 1021 cm−3. La figure 1.5 illustre les valeurs de SEE (irradiance threshold, [W/cm2]) et d’exposition énergétique (radiant exposure threshold, [J/cm2]) en fonction de la longueur des impulsions laser pour quelques longueurs d’onde. On remarque sur les 2 graphiques que la dépendance avec la longueur d’onde s’efface avec les durées d’impulsion plus courtes devenant même négligeable pour des impulsions femtosecondes [31]. De plus, malgré le fait que le SEE augmente avec des impulsions plus courtes, l’exposition énergétique déposée dans le milieu diminue [32]. Finalement, le SEE dépend très peu du coefficient d’absorption linéaire de l’eau (ou du matériau dans lequel s’effectue l’ablation).