MODELISATION EPIDEMIOLOGIQUE DE LA CIRCULATION DU VIRUS
Infection dans un système d’élevages
La domestication des espèces animales depuis l’antiquité, a crée un système agricole favorisant la mixité de plusieurs espèces animales dites domestiques (carnivores, oiseaux, etc.).
Origine de la poule domestique
La poule domestique (Gallus gallus domesticus) tire ses origines de plusieurs espèces de volailles sauvages du sud-est de l’Asie mais aucun de ces ancêtres n’existe encore. Des fouilles archéologiques ont montré la présence de poules domestiquées dès l’an 6000 Av J.C. en Chine. Mais, il semble que la domestication soit plus ancienne et que le site primaire de domestication soit localisé dans le Nord de l’Asie. Un courant de migration des populations humaines a été documenté, du Nord vers le sud de l’Asie (Swayne, 2008). En 2500 Av. J.C., les poules sont retrouvées en Europe et en Asie de l’ouest. Les poules ont été utilisées pour la religion et non pas comme source d’alimentation. Les Egyptiens ont été les premiers à se concentrer sur la poule comme une activité agricole et ont développé les premiers incubateurs artificiels d’œufs. Les poulets ont été largement disséminés par la civilisation grecque, mais ce sont les romains qui en développent les techniques d’élevages et les prennent comme symbole religieux. Les Perses organisent des combats de coqs et les grecs développent plusieurs races de poulets. L’élevage de poulets de pure race a commencé au 18e siècle en Europe et en Amérique du Nord. Déjà, à cette période, il existait des exhibitions de poulets et les poulets utilisés comme des animaux de compagnie. L’organisation de la production alimentaire moderne du poulet a commencé dans les années 1800 en Europe, d’abord pour produire des œufs et ensuite de la viande, à tel point qu’il a été recensé en 1910, 280 millions de poulets chez près de 5,5 millions de fermiers aux Etats-Unis. Les efforts pour l’amélioration génétiques et nutritionnels ont commencé en 1950, dans le but de produire les poulets rapidement avec une augmentation de leur croissance (Smith & Dunipace, 2011). Ainsi, de par le monde, la poule est la principale espèce aviaire domestique élevée pour l’alimentation humaine avec la production d’œufs et de viande. Ainsi, l’homme a crée de nouvelles niches pour les oiseaux en dehors de leur milieu naturel avec la captivité et la domestication (Swayne, 2000).
Transmission du virus
IA d’oiseaux sauvages aux oiseaux domestiques Chez la plupart des oiseaux sauvages aquatiques, adaptés au virus IAFP, les virus se répliquent dans le tractus digestif et sont excrétés dans les fèces. Ces infections ne sont pas, pour la majorité, associées à l’apparition de signes cliniques. Cependant, quand ces virus passent aux oiseaux domestiques terrestres (principalement poules et dindons mais aussi aux pintades, faisans, etc.) et aquatiques (oies et canards), il peut en résulter une infection selon deux processus consécutifs: (1) exposition à un oiseau infecté et (2) adaptation au nouveau hôte (Swayne, 2007). Cette exposition à l’IAFP se fait par contact direct ou indirect par un vecteur. Quant à l’adaptation à l’hôte, elle se fait de manière sporadique avec une transmission inefficace entre les oiseaux jusqu’à l’adaptation du virus à l’hôte, ce qui se traduit par l’apparition de signes cliniques et d’une maladie transmissible entre les oiseaux ou une transmission non efficace avec la disparition du virus avec la mort de l’hôte primaire infecté. Ce virus IAFP adapté à un nouvel hôte domestique, peut rarement infecter une population d’oiseaux sauvages. De plus, ce virus IAFP adapté a rarement été à l’origine de dissémination secondaire de fermes à fermes. Cependant, des virus de type H5 ou H7, peuvent changer subitement et devenir hautement pathogènes par le clivage des protéines de l’hémagglutinine (Perdue et al., 1999). Ce virus de l’IAHP semble infecter d’autres oiseaux domestiques ou sauvages comme ce fut le cas pour le virus de l’IAHP, décrit pour la 1ère fois en Chine chez une oie en 1996, suivi par des infections de poulets à Hong Kong en 1997 et la diffusion mondiale que nous connaissons. Les oiseaux sauvages (ex : Moineau domestique) peuvent servir de vecteurs mécaniques ou biologiques du virus IAHP et donc être responsables de la dissémination de fermes à fermes, de village à village. Aussi, le canard domestique est devenu le réservoir majeur du virus de l’IAHP en Asie et en Afrique (Hulse-Post et al., 2005 ; Sims et al., 2003).
Transmission du virus IA d’oiseaux villageois à des oiseaux d’élevage
Le plus grand risque d’introduction de l’IA chez les oiseaux d’élevage est incontestablement par les oiseaux villageois ou traditionnels infectés. Ainsi, aux Etats-Unis, le virus H7N2 est devenu endémique par cette voie dans le Nord du pays de 1994 à 2006, en commençant par la Pennsylvanie et continuant en Virginie, en Caroline du Nord, puis le Connecticut (Swayne, 2008). Le mode de contagion est souvent par contact direct avec un oiseau infecté ou par contact indirect avec des vecteurs tels que les cageots, les chaussures et les habits souillés des employés (Swayne, 2008). Concernant l’épizootie du virus H7N2 (IAFP) aux Etats-Unis notamment en Pennsylvanie, l’épizootie a débuté par le contact d’un marchand de volailles dites traditionnelles avec des fermes d’élevages. Près de 450 contacts ont été enregistrés en 3 mois avec des fermes environnantes (Henzler et al., 2003). De tels risques peuvent être réduits par la formation des employés sur les risques d’introduction de l’IA et le respect des règles de biosécurité. S’il doit y avoir des contacts entre des personnes de ces deux systèmes, de nouvelles règles de biosécurité plus strictes doivent être édictées pour éviter l’introduction de pathogènes en désinfectant et nettoyant les cageots, les véhicules, les habits et les bottes (Swayne, 2008). Le transport du virus de l’IA par voie aérienne ou par le vent peut arriver si les oiseaux villageois sont gardés dans la ferme d’élevages d’oiseaux ou dans les marchés. Cependant, l’eau constitue une faible source de contamination pour ce système. L’extension de cette introduction du virus se fait par deux voies : le contact direct par le mouvement des oiseaux infectés tels que les poulettes dans des fermes de production d’œufs qui ne privilégie pas l’élevage en bandes ; puis par le contact indirect par le mouvement des vecteurs infectés tels que les équipements et matériels infectés, les habits et les chaussures vers des élevages non infectés.
Facteurs de risque d’introduction et de maintien du virus dans ce système
La fréquence des infections due au virus de l’IA dans les différents systèmes de production développés par les pratiques humaines varie selon plusieurs facteurs notamment le système agricole appliqué, la densité des volailles produites, le niveau de biosécurité appliqué, le pays et le système commercial de la filière avicole. Dans la plupart des pays industrialisés, l’IAHP a été rare et l’IAFP sporadique dans les 25 à 30 milliards de poulets produits annuellement (Swayne, 2008). Les infections dues à l’IAFP ont été signalées dans les élevages de dindes et très rarement chez les poulets (Swayne & Halvorson, 2008). Cependant, les infections ont été plus fréquemment rapportées dans les pays en voie de développement, notamment dans les élevages villageois et quelques élevages d’oiseaux dits modernes. Ainsi, depuis 2003, l’IAHP est devenu endémique dans les pays Asiatiques et a été maintenu dans les élevages villageois grâce à des canards domestiques. Dès que le virus de l’IA est apparu dans le système industriel, il s’est rapidement étendu de fermes en fermes quand les mesures primaires de biosécurité n’existaient pas ou étaient inadéquates, résultant en l’épizootie que l’on a connue ces dernières années. Trois facteurs semblent être importants dans l’évaluation du risque d’introduction et de maintien du virus de l’IA. Il s’agit de l’élevage en plein air, la susceptibilité d’espèces et la faiblesse des moyens de contrôle et de la biosécurité (Swayne, 2008). L’élevage en plein air ou en divagation, constitue un facteur de risque majeur de transmission du virus de l’IA des oiseaux sauvages. Ce système de production est le plus important dans les pays en voie de développement et demeure le système majeur de production de la filière avicole traditionnelle. Ce type de production est plus favorable à l’introduction et au maintien du virus que dans les pays développés qui privilégient la production en bâtiments fermés. Les virus IAFP provenant d’oiseaux aquatiques sauvages sont plus adaptés aux oiseaux aquatiques domestiques, permettant un transfert facile entre ces deux groupes. De plus, des études indiquent que les dindes, les faisans et les cailles du japon sont plus sensibles au virus de l’IA que les poulets (Humberd et al., 2006 ; Perez et al., 2003 ; Swayne & Halvorson, 2008). La cohabitation de plusieurs espèces de volailles dans le système traditionnel domestique favorise les échanges de pathogènes et le début des infections. Ces espèces peuvent constituer des hôtes intermédiaires et permettre ainsi l’adaptation du virus aux poulets. Le manque de contrôle des mouvements des volailles et la faiblesse de la biosécurité sont associés à la propagation du virus IAHP en Europe entre 1900 et 1930 (Stubbs, 1948). La mise en pratique des contrôles des mouvements, l’établissement de protocoles de nettoyage et de désinfection, le vide sanitaire des marchés et d’autres mesures ont permis l’éradication du H5N1 HP dans les marchés de Hong Kong (Sims et al., 2000) et des mesures similaires ont permis d’éliminer le H7N2 FP du système de production non industriels du Nord des EtatsUnis (Trock, 2007 cité par Swayne, 2008). Les activités à haut risque doivent être réduits ou contrôlés, notamment le déplacement des oiseaux infectés morts pour leur destruction sans les avoir scellés et la non décontamination des véhicules de transport (Bowes et al., 2004). De plus, les producteurs de volailles doivent élever une seule espèce d’oiseaux et avoir un système de production d’oiseaux de même âge de type « all-in-all-out », avec des mesures de biosécurité appropriées. 1.5. DIAGNOSTIC 1.5.1. Diagnostic sur le terrain La présentation clinique de l’Influenza aviaire varie selon la souche virale et l’espèce réceptrice. Il n’y a pas de lésions pathogmoniques, ce qui rend le diagnostic de la grippe aviaire sur le terrain assez difficile. De plus, il existe une similitude de signes cliniques avec ceux d’autres maladies aviaires comme la maladie de Newcastle. La suspicion de grippe aviaire repose sur les éléments épidémiologiques, cliniques et lésionnels qui sont identiques lors de la maladie de Newcastle. La vaccination des volailles contre la maladie de Newcastle pourrait servir lors du diagnostic différentiel et accroitre la suspicion de l’IAHP. Le diagnostic différentiel se fait avec certaines maladies comme la forme aiguë du choléra aviaire, la maladie de Newcastle à souches vélogènes, les maladies respiratoires, comme la laryngotrachéïte infectieuse (OIE, 2007). Lors de suspicion d’IAHP, des précautions standards doivent être prises par les personnes effectuant les prélèvements pour éviter d’être exposées à leur tour à cette anthropozoonose.
Diagnostic au laboratoire
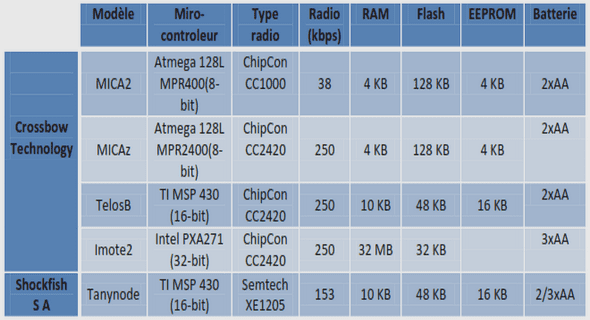
Les tests de diagnostic pour le virus IA peuvent être classifiés comme spécifiques au type A (peu importe la souche virale ou l’espèce animale) ou au sous-type. Ces tests permettent de détecter uniquement le sous-type spécifique (généralement H5 ou H7 car ils sont les plus pathogènes). La détection d’une infection par le virus de l’IA nécessite un prélèvement adéquat. Ainsi, pour la détection de virus IA faiblement pathogène, il est recommandé de ne pas prélever de tissus excepté le poumon. Lors de suspicion de virus IAHP, plusieurs tissus (poumon, cœur, rein, pancréas) peuvent être prélevés. Le type de prélèvement réalisé et les méthodes de conservation sont des facteurs importants pour la réussite du diagnostic de laboratoire. Si le but du test est de détecter l’exposition au virus IA, les tests de détection des anticorps est optimal mais quand il s’agit de rechercher une infection active, il convient mieux de faire des prélèvements de tissus ou d’organes où se sont répliqués les virus. De plus, il est important que la chaine de froid soit maintenue quelque soit le prélèvement si l’on veut faire l’isolement viral ou la RT-PCR. Il est recommandé de faire un écouvillonnage cloacal pour la recherche de virus IAFP chez les espèces aquatiques car ces virus se répliquent dans le tractus intestinal. Cependant, chez les poules, l’infection est plutôt localisée dans le tractus respiratoire (trachée ou oropharynx), ce qui indique qu’un écouvillon trachéal est le plus approprié (Swayne et al., 1998 ; Spackman & Suarez., 2008). Ces écouvillons doivent être mélangés dans 2-3 ml d’une solution contenant un milieu de transport stérile isotonique contenant des suppléments d’antibiotiques et une source de protéines (0,5% [V/V] d’albumine de sérum de bovin). Les principaux tests de laboratoires sont consignés dans le tableau II (page 32).
Introduction |