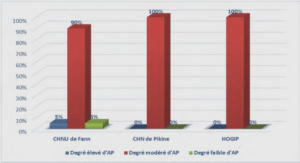
L’HYDRATATION
Dans ce paragraphe, on décrit les différentes réactions chimiques qui constituent l’hydratation d’un ciment et d’une éventuelle pouzzolane. On étudie ensuite les moyens de quantifier l’hydratation, ce qui permet dans la foulée d’évoquer la cinétique du phénomène. Cette approche quantitative est nécessaire, vis-à-vis de notre objectif de modélisation ultérieure. L’arrêt des réactions et les quantités finales de produits formés sont abordés dans la fin de cette partie.
Réactions d’hydratation et pouzzolaniques
On présente, dans les paragraphes qui suivent, les réactions d’hydratation du ciment et les réactions pouzzolaniques de la chaux avec une fumée de silice ou une cendre volante silicoalumineuse. Ces deux types de réactions sont présentés séparément. Dans une pâte de ciment, un mortier ou un béton, les réactions sont concomitantes. On fait néanmoins l’hypothèse qu’elles ne sont alors pas fondamentalement différentes de celles présentées dans ce qui suit.
Les réactions d’hydratation du ciment
Le ciment est un mélange de gypse et de clinker broyé. Ce dernier, produit de la cuisson à haute température d’un mélange d’argile et de calcaire, est constitué de cristaux d’alite (C3S1 ) et de bélite (β-C2S) noyés dans une pâte composée d’aluminate tricalcique (C3A) et d’une solution solide de chaux, d’alumine et d’oxyde de fer – généralement considérée comme étant 1 Notation des cimentiers : voir page x. 5 Chapitre I de l’aluminoferrite tétracalcique (C4AF) –, des composants mineurs complétant l’ensemble [BOGUE 1947, COPELAND ET KANTRO 1964, LEA 1970, TAYLOR 1990].
Les produits de l’hydratation des silicates de calcium sont des silicates de calcium hydratés (C-S-H) et de la chaux, les aluminates donnant des (sulfo-)(ferro-)aluminates de calcium hydratés. Un ciment « moyen » produit ces trois types d’hydrates dans des proportions approximatives de 70, 20 et 10 % respectivement [OLLIVIER 1989]. Les mécanismes des réactions d’hydratation du ciment font encore aujourd’hui l’objet d’interrogations. En 1887, Le Chatelier proposait sa théorie de dissolution-diffusioncristallisation [LE CHATELIER 1887].
Après plus de cent ans d’évolution des connaissances et des techniques, les mécanismes de naissance et de croissance des hydrates sont mieux compris [VAN DAMME 1994]. L’hydratation des silicates Au contact de l’eau, le C3S commence immédiatement à se dissoudre. Un premier type de CS-H précipite, ce qui provoque un premier pic de dégagement de chaleur. L’hydratation se poursuit ensuite très lentement (période dormante) puis s’accélère, le début de l’accélération coïncidant avec la précipitation de la chaux (CH).
A la fin de la période dormante, le degré d’hydratation de C3S est de quelques %. L’intensité de la réaction (dissolutions et précipitations) passe par un maximum et décroit ensuite rapidement. La nature des C-S-H évolue tout au long ces différentes périodes. Après le pic, la réaction se poursuit de plus en plus lentement pendant des temps pouvant atteindre des dizaines d’années
L’hydratation de C2S est similaire à celle de C3S. Plus lente (10 à 30 fois) que celle de C3S, elle suit également un processus de dissolution-précipitation [RILEM 1987]. Les C-S-H sont des hydrates mal cristallisés et leur structure est encore mal connue. Leur stœchiométrie évolue tout au long de l’hydratation. On s’accorde généralement pour attribuer au rapport C/S une valeur finale proche de 1,7 [VERNET 1994]. Cela donne les stœchiométries suivantes : C3S + (1,3+y) H → C1,7SHy + 1,3 CH (I.1) C2S + (0,3+y) H → C1,7SHy + 0,3 CH.
L’hydratation des aluminates
Si le ciment ne contenait pas de sulfates (sous forme de gypse : CS H2), l’hydratation du C3A produirait un phénomène de prise « éclair ». Lorsqu’il y en a, une première réaction rapide « bloque » l’hydratation de C3A, laissant aux autres réactions d’hydratation le temps de se dérouler. Une deuxième réaction vient, ensuite, transformer les produits de la première réaction en d’autres corps plus stables.
Dans un premier temps, C3A et CS se dissolvent rapidement. Cette dissolution est très exothermique et sursature rapidement la solution par rapport au trisulfoaluminate de calcium hydraté (AFt) − ou ettringite5 −, de formule C6AS 3H31, qui précipite. Cette précipitation se poursuit lentement jusqu’à épuisement du gypse.
La solution devient alors sous-saturée en gypse. L’aluminate réagit avec les ions sulfates pris sur l’ettringite qui se redissout pour donner le monosulfoaluminate de calcium hydraté (AFm), de formule C4AS H12, qui se présente sous forme de solution solide. Cette nouvelle réaction entraine une dissolution de l’aluminate tricalcique anhydre Pour les teneurs usuelles des ciments en sulfates − 0,7 à 1,2 mol/(mol de C3A) −, l’ettringite se transforme pratiquement en totalité en monosulfoaluminate [MASSAZZA ET DIAMON 1992].