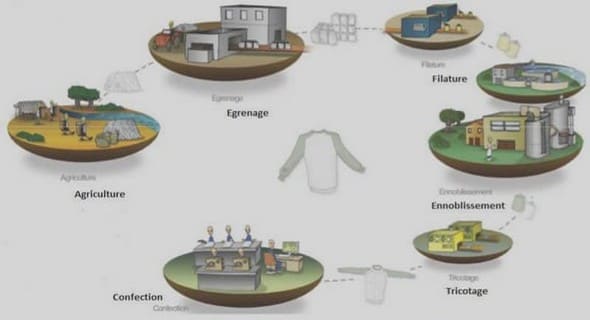
Les tumeurs bénignes du sein
Histologie du sein et Cytopathologie
Etude histologique du sein
Le sein, constitué de la glande mammaire proprement dite, de tissu conjonctif, de tissu adipeux, de vaisseaux sanguins et lymphatiques, de nerfs et de ligaments suspenseurs du sein, a pour fonction primaire la synthèse, la sécrétion et l’éjection du lait. Sa structure interne de base est composée de 15 à 25 canaux galactophores qui débouchent à la surface du mamelon par des pores indépendants. Le tissu mammaire renferme des récepteurs hormonaux œstrogéniques (ER) et progestéroniques (PR) concentrés en particulier dans la zone glandulaire et dont le nombre varie avec l’âge (Villeneuve, 2011). Le développement de la glande mammaire est particulier puisqu’il se fait tardivement, et que celleci subit un remodelage au cours de la vie. La glande mammaire est rudimentaire à la naissance. C’est à la puberté que s’effectue une grande part de son développement. L’action de la testostérone en inhibe le développement chez l’homme, alors que chez la femme, l’action des hormones ovariennes le stimule. On observe alors une accumulation de tissus adipeux et fibreux, qui occupe 80% ou plus du volume du sein chez une femme adulte n’allaitant pas. Au cours des cycles menstruels subséquents, on observe une phase de prolifération légèrement accrue lors de la phase lutéale du cycle, avec une augmentation du volume du sein qui peut atteindre jusqu’à 15% (Potten, 1988). C’est au moment de la première grossesse menée à terme que la différenciation la plus poussée se produit. À ce moment, les changements hormonaux associés à la grossesse produisent une croissance et une prolifération intenses, et induisent la formation des acini sécrétoires, une augmentation de la quantité de tissu adipeux et une augmentation du flux sanguin. Au moment du sevrage, la glande mammaire involue jusqu’à la grossesse suivante. Le dernier changement important de la glande mammaire survient après la ménopause. À ce moment, il y a arrêt de la production des hormones ovariennes, ce qui provoque une involution de la glande mammaire. (Desjardins, 2010). Figure 1. Histologie du sein et localisation des tumeurs bénignes mammaires (www.rubanrose.org)
Cycle cellulaire et division anarchique des cellules
Tous les organismes sont constitués de cellules qui se multiplient par division cellulaire. Ce processus, extrêmement complexe appelé cycle cellulaire, doit avoir lieu d’une façon régulière, précise et avec une synchronisation parfaite assurant que chaque cellule fille reçoive la bonne quantité d’ADN et soit capable, à la fin de la division cellulaire, de former une nouvelle cellule indépendante et fonctionnelle. Il est composé de cinq phases distinctes, G0 (repos), G1, S (synthèse), G2 (avec G1 + S + G2 appelés interphase) et la phase M ou mitose (Little, 2010). Après la division cellulaire, la cellule fille peut soit continuer à se diviser, soit cesser cette croissance active. Dans le deuxième cas, la cellule entre dans un état de quiescence appelé phase G0 (Pommier et Kohn, 2003). La plus grande partie de nos cellules sont en G0, mais sous certaines conditions les cellules peuvent sortir de G0 et recommencer à se diviser. La progression du cycle cellulaire repose sur l’activation d’un facteur de transcription, la protéine E2F, qui, se fixant sur l’ADN, active la plupart des gènes nécessaires à la phase S (Michalowski, 2006). Parallèlement à cet activateur de la phase de synthèse de l’ADN et de la réplication des chromosomes, la protéine Rb possède la propriété essentielle de pouvoir se fixer sur le facteur de transcription E2F et de bloquer ainsi la progression de la phase de synthèse (S) (Harbour et al., 2000). Dans les conditions normales, la prolifération et la mort cellulaires sont deux processus en équilibre qui permettent d’assurer l’homéostasie dans un tissu donné (Guo et Hay, 1999 ; Soussi, 2001). Cette capacité de se diviser, de se spécialiser, mais aussi de mourir est inscrite dans le génome de chaque cellule saine. Sous l’influence de facteurs de l’environnement, de certains agents chimiques ou physiques, ou encore de certains virus (Vasseur, 2011), le génome humain subit des altérations, appelées mutations génétiques, qu’il est en mesure de réparer. Lorsque ce système de réparation est défectueux ou débordé, la cellule conserve ces mutations et devient anormale. La prolifération incontrôlée aboutit alors à la formation d’une tumeur. Celle-ci est dite bénigne lorsqu’elle est caractérisée par une délimitation précise sans envahissement du tissu normal. Néanmoins certaines de ces lésions peuvent devenir malignes et prolifératives (Desjardins, 2010 ; Boisvert, 2013). La prolifération de ces cellules qui dérivent généralement d’un clone cellulaire est liée à des altérations au niveau des proto-oncogènes (gènes qui régulent la prolifération dans les cellules normales comme les gènes Ras ou c-abl), qui s’activent alors en oncogènes et des gènes suppresseurs de tumeurs ou anti-oncogènes (comme le p53) ainsi qu’à un dysfonctionnement de l’ADN face à la régulation du cycle cellulaire et au système de réparation du génome (Poehlmann et Roessner, 2010 ; Hanahan et Weiberg, 2011).
Tumeurs bénignes du sein et risque de cancer
Les tumeurs bénignes et les mastopathies complexes correspondent à un ensemble lésionnel très ~ 5 ~ vaste auquel le pathologiste se trouve souvent confronté dans sa pratique quotidienne et soulevant divers problèmes de classification, de définition histologiques, de diagnostic différentiel avec le cancer in situ ou infiltrant, de potentialité évolutive et de filiation entre ces lésions (Tranbaloc, 2006). Leur risque est modulé selon le caractère prolifératif de ces lésions conduisant à une classification en trois catégories : les lésions non prolifératives (cellules qui se divisent très lentement), les lésions prolifératives sans atypie (cellules se divisant rapidement) et les lésions prolifératives avec atypie (cellules anormales se divisant rapidement). Les lésions non prolifératives et prolifératives sans atypie sont associées à un faible sur-risque de cancer du sein, alors que les lésions prolifératives avec atypie multiplient le risque par quatre environ (Dupont et Page, 1987 ; Key et al., 2001).
Typologie
On distingue parmi les tumeurs bénignes, celles sans relation avec le cancer du sein (gynécomastie, maladie fibreuse) et les mastopathies bénignes pouvant être associées au cancer (Picard, 2003). Parmi les plus étudiées peuvent être cités
Kystes
Ils appartiennent à la famille des « maladies » dites « mastose fibro-kystique » : l’affection mammaire la plus commune et qui concerne surtout les femmes avant la ménopause, de 40 à 50 ans, atteintes de dysovulation avec insuffisance lutéale et est quasi constamment bénin (Bonnier et al., 2005). Ils sont dus à une prolifération épithéliale pouvant être isolés ou plus souvent disséminés dans un ou deux seins (Picard, 2003) et sont des anomalies liquides ou semi-liquides. Les contours peuvent être masqués par la densité du parenchyme avoisinant et, dans les seins denses, ils sont fréquemment non visibles. Le diagnostic est facile lorsque les parois se calcifient, réalisant des calcifications en coquille d’œufs (Deschildre et al., 2006). L’échographie est cependant nécessaire pour prouver la nature liquidienne de la structure (Boisvert, 2013).
Fibroadénome
C’est la plus fréquente des tumeurs solides bénignes du sein touchant préférentiellement les jeunes patientes âgées de 20 à 40 ans (Boisvert, 2013). Il est dû à une prolifération mixte canalaire épithéliale et fibroblastique stromale. Cliniquement, il correspond à un nodule ferme, souple, bien limité, à bords nets et mobile (Bonnier et al., 2005 ; Chauvet, 2006). Dans 50 % des cas, il peut s’agir d’une forme complexe (Guray, 2006), définie par la présence de lésions de type adénose sclérosante, métaplasie apocrine, ectasie canalaire, fibrose floride, etc. Dans ce cas, le risque de cancer semble légèrement augmenté avec un risque relatif estimé aux alentours de 1,02 % (Hartmann, 2005).
Tumeur phyllode de grade
Il s’agit d’une tumeur fibro-épithéliale, constituée d’une double composante épithéliale et conjonctive. Ce type de tumeurs représente 0,3 % à 0,9 % des tumeurs mammaires chez la femme, et 2 à 3 % des tumeurs mammaires fibro-épithéliales (Chauvet, 2006). Pour certains pathologistes, les phyllodes peuvent aussi avoir des formes malignes au départ du tissu conjonctif : les grades II et III (Picard, 2003). Ces tumeurs phyllodes présentent les mêmes caractéristiques mammographiques, échographiques et histologiques que les fibroadénomes. Ce sont des lésions palpables plus profondes et généralement plus volumineuses, ce qui demande une biopsie. Une exérèse chirurgicale est toujours recommandée devant un diagnostic de phyllode en raison d’un potentiel de malignité, avec des métastases rapportées dans 6 à 22% des cas (Boisvert, 2013).
Papillomes intracanalaires
Ce sont des néoplasmes épithéliaux bénins (Picard, 2003), apparaissant sous la forme d’une lésion arborescente (papillaire) qui prolifère à l’intérieur d’un ou plusieurs galactophores voisins, le plus souvent rétro-aréolaire (Bonnier et al., 2005). Il faut distinguer le papillome solitaire rétromamelonnaire, des papillomes multiples appelés papillomatoses. Ces dernières sont plus petites et plus périphériques (Deschildre et al., 2006) et les patientes atteintes présentent souvent une histoire familiale positive de néoplasie mammaire, et sont plus à risque de développer un cancer du sein (Boisvert, 2013).
Adénomes
Ce sont des tumeurs bien délimitées, composées de structures épithéliales bénignes avec un stroma très pauvre contrairement au fibroadénome qui possède une composante stromale. L’âge d’apparition et l’aspect clinique identiques à ceux des fibroadénomes, évoquent souvent une tumeur maligne (Bonnier et al., 2005).
Hamartome
L’hamartome correspond à une lésion bénigne rare. Il s’agit d’une tumeur cliniquement souple et bien limitée. L’image mammographique typique, retrouvée dans un tiers des cas, correspond à une opacité ronde limitée par un liseré clair traduisant l’expression de “sein dans le sein” (Chauvet, 2006), parfois très volumineuses et pouvant alors déformer le sein (Bonnier et al., 2005). La gravité des tumeurs, qu’elles soient « bénignes » ou « malignes » n’est pas toujours strictement liée à leur nature histologique. Les tumeurs bénignes sont bien différenciées, grossissent peu, évoluent lentement, envahissent peu ou pas les tissus voisins (Larousse, 2014). Cependant elles peuvent avoir une évolution plus grave si elles altèrent le fonctionnement d’un organe, si elles sont diagnostiquées tardivement ou encore si leurs situations rendent l’ablation chirurgicale difficile.
Epidémiologie
Selon le National Cancer Institute des États-Unis et la Société Canadienne du Cancer, le tissu mammaire subit des changements microscopiques chez presque toutes les femmes, dès la trentaine. Ces changements deviendront perceptibles chez une femme sur deux, qui détectera une masse ou ressentira une douleur aux seins. Dans 90 % des cas, ces masses aux seins sont bénignes, souvent de simples kystes3 . Les données existantes en Afrique sont rares car les relevés épidémiologiques y compris histopathologiques sont souvent inexistants. C’est le cas en Afrique subsaharienne (Apffelstaedt, 2008), notamment au Sénégal, où il n’existe pas de politique de dépistage du cancer du sein par la mammographie (Dem et al., 2008). Dans les pays à haut niveau socio-économique, les femmes sont sensibilisées sur les pathologies du sein et le dépistage de masse, et le cancer du sein y est diagnostiqué à des stades plus précoces offrant ainsi les meilleures chances de survie, (Ly, 2011), et surtout de se rendre compte de la grande fréquence de ces lésions bénignes du sein (Boisvert, 2013). Ainsi, à défaut de ces programmes de dépistage de masse, les patientes ayant un risque potentiel de cancer du sein de même que les femmes présentant un problème de sein dense, comme le personnel traitant, devraient bénéficier d’une bonne sensibilisation.
Aspects génétiques des tumeurs bénignes
Les cellules d’un organisme accumulent au fil du temps des mutations qui peuvent altérer leur comportement, en particulier leur prolifération. C’est ainsi que des cellules mutantes peuvent évoluer et former des tumeurs. Déjà en 1976, le cancérologue Peter Nowell avance l’idée que les tumeurs suivent les lois de l’évolution découvertes par Darwin. Lorsque la plupart des tumeurs restent bénignes et passent inaperçues, certaines, en revanche, dégénèrent en cancer quand leur croissance devient incontrôlée. La maladie s’aggrave encore lorsque les cellules tumorales, à la suite de nouvelles mutations, deviennent mobiles et forment des métastases4 .
Tumorigenèse
Les changements génomiques somatiques sont des aberrations de l’ADN qui se sont accumulées dans le génome d’une cellule pendant la durée de vie de l’individu. Ces mutations ponctuelles qu’elles soient des suppressions, des fusions ou des amplifications de gènes, ou encore des réarrangements chromosomiques, pour la plupart des ‘‘mutations bénignes’’, entrainent un mosaïcisme somatique chez les individus sains (De, 2011). Près de 500 gènes connus (Forbes, 2008) sont aujourd’hui liés au déclenchement de la tumorigenèse (Podlaha et al., 2013). L’apparition d’hyperplasies épithéliales (ou prolifération anormale des cellules) constitue l’étape précoce de la tumorigenèse mammaire (Chiche, 2012). Les étapes précédentes de la maladie 3 passeportsante.net 4 lemonde.fr ~ 8 ~ bénigne du sein sont mal comprises, toutefois, des études récentes ont permis d’identifier des altérations dans les cellules du stroma qui peuvent être critiques pour la progression des tumeurs bénignes en cancer invasif (Magdalena et al., 2010). Les études les plus récentes des gènes BRCA 1 et 2 comme marqueurs de cancer du sein, ont conduit à l’identification d’un certain nombre de gènes de susceptibilité au dommage de l’ADN, dont ATM, BRIP1, CASP8, CHEK2, NBN, PALB2, PTEN, TP53 et STK11 (Desrichard et al., 2011; Shuen et al., 2011; Van-Der-Groep et al., 2011; Zhang et al., 2011 ; Ma et al., 2012).
Remerciements |