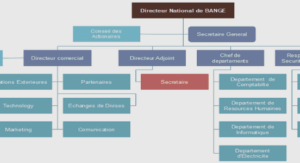
LES DIPHOSPHINES STEREOCHIMIQUEMENT DYNAMIQUES
Télécharger le fichier original (Mémoire de fin d’études)
Diphosphines comportant un seul type de chiralité
Les diphosphines à chiralités centrales portées par les carbones
De nombreuses diphosphines présentant des chiralités centrales ont été synthétisées depuis la DIOP et la DIPAMP. Pour illustrer la famille des diphosphines à chiralité centrale portée par des carbones, nous avons choisi la DUPHOS10 de Burk et coll., dans laquelle les phosphores sont inclus dans un cycle chiral saturé (schéma I.7).
Cette synthèse est réalisée en deux étapes à partir d’un diol chiral, énantiomériquement pur. Ce dernier réagit avec le chlorure de thionyle pour donner un sulfite cyclique oxydé en sulfate par RuCl3. Ce composé peut alors réagir, avec inversion de configuration, avec la diphosphine pour conduire au DUPHOS. L’inconvénient de cette synthèse est l’obtention du diol chiral de départ, qui doit soit être préparé au laboratoire, soit être disponible chez les revendeurs.
La (R,R)-Me-DuPHOS s’est avérée très performante en particulier pour l’hydrogénation asymétrique des alcènes catalysée par des complexes de ruthénium. Cette réaction est utilisée industriellement par Firmenich pour la synthèse d’une fragrance, la Paradisone®, utilisée en parfumerie11 (schéma I.8).
Hors du cadre industriel, il est intéressant de souligner qu’un complexe cationique du rhodium, contenant le ligand iPr-DUPHOS, est particulièrement actif et sélectif dans l’hydrosilylation intramoléculaire asymétrique de certaines α-siloxy-cétones, avec des rendements de 100% et des excès énantiomériques allant jusqu’à 93% 12 . Notons enfin l’utilisation du ligand Et-DUPHOS, qui, toujours associé au rhodium, permet l’hydrogénation de liaisons C=N, avec une énantiosélectivité supérieure à 90% pour la plupart des substrats13.
Les diphosphines à chiralités centrales portées par les phosphores
En dépit du succès de la DIPAMP synthétisée par Knowles dans les années 1970, la famille des diphosphines chirales au phosphore est restée relativement pauvre jusqu’à la fin du XXème siècle, probablement à cause des difficultés liées à la synthèse asymétrique ou au dédoublement. Cependant, depuis 1998, un regain d’intérêt pour ce type de diphosphines chirales peut être observé.
Entre les années 1998 et 1999, Imamoto et coll. ont décrit deux nouvelles diphosphines chirales aux phosphores : le BisP*14 et la MiniPhos15, dont la synthèse est présentée sur le schéma I.9. Pour cette synthèse, Imamoto utilise une méthode de déprotonation énantiosélective grâce à la (-)-spartéine, produit commercial et peu onéreux. Il faut tout de même noter dans le cas de la MiniPhos, la formation du produit méso, qu’il faut éliminer par recristallisation. Le rendement global de la réaction s’en trouve alors fortement diminué (entre 13 et 28% suivant la nature des groupements R).
Ces ligands induisent une très bonne stéréosélectivité en hydrogénation asymétrique, puisque les excès énantiomériques obtenus sont supérieurs à 90 % dans la plupart des catalyses classiques développées en laboratoire13, 14 (hydrogénation des déhydroaminoacides, de l’acide itaconique et ses dérivés, des énamides …).
Les diphosphines à chiralité axiale.
La famille des diphosphines à symétrie C2 la plus étudiée, et la plus utilisée, est certainement celle des diphosphines à chiralité axiale, probablement grâce à la découverte en 1980 de la BINAP16 par Noyori et Takaya, dont la synthèse est présentée sur le schéma I.10.
La synthèse de la BINAP est relativement simple, puisqu’elle ne comporte que quatre étapes principales. Cependant, elle implique une étape de dédoublement avec l’acide camphosulfonique ou benzoyltartrique énantiomériquement pur comme auxiliaire chiral.
La société Takasago a utilisé un des ligands dérivé de la BINAP, le tol-BINAP comme inducteur asymétrique, pour la production industrielle d’une molécule naturelle, le (-)-menthol17 (schéma I.11). L’étape clé de cette synthèse est l’isomérisation stéréosélective de doubles liaisons allyliques C=C catalysée par un complexe du rhodium18. Depuis les années 1985, la production du (-)-menthol s’élève à 1500 tonnes par an.
Cette même société a mis au point un procédé industriel de synthèse d’une acétoxyazétididinone chirale, intermédiaire dans la synthèse d’antibiotiques de la famille des carbapénèmes, dont l’étape clé consiste en l’hydrogénation asymétrique d’une cétone, à l’aide d’un complexe Ru/BINAP (schéma I.12).
Les diphosphines à chiralité planaire.
Les diphosphines ferrocéniques représentent une classe importante de diphosphines à chiralité planaire.
La première synthèse d’une diphosphine ne comportant que la chiralité planaire a été décrite en 2000 par Kagan et coll.19. La synthèse est présentée sur le schéma I.13.
La stratégie de cette synthèse repose sur la déprotonation diastéréosélective d’un acétal ferrocénique chiral obtenu à partir d’un aldéhyde ferrocénique. Le dérivé lithié obtenu conduit en quatre étapes à la diphosphine désirée..
La diphosphine ferrocénique, associée au rhodium, s’est avérée très active en hydrogénation asymétrique à pression atmosphérique, avec de nombreux substrats16 (dehydroaminoacides, énamides, acide itaconique et ses esters…). Les excès énantiomériques peuvent atteindre 96% dans le cas de l’hydrogénation du diméthyle itaconate.
Diphosphines combinant plusieurs éléments de chiralité.
Afin d’obtenir des inducteurs asymétriques plus performants par effet d’amplification (augmentation du caractère chiral du complexe actif en catalyse), de nombreuses équipes ont élaboré des diphosphines combinant différents types de chiralité au sein de la même molécule.
Les diphosphines de type JOSIPHOS22, développées par Togni et coll., combinent chiralité centrale et axiale. Ces ligands, associés au rhodium ou à l’iridium, sont très actifs et sélectifs en hydrogénation asymétrique de doubles liaisons C=C et C=N. Cette réaction a été exploitée industriellement pour la synthèse d’un herbicide, le (R)-Métolachlore23. L’inducteur asymétrique utilisé est la XYLIPHOS dont la synthèse industrielle est présentée sur le schéma I.14.
Malgré le nombre important d’étapes nécessaires à la synthèse de ce composé, la difficulté de certaines étapes (dédoublement enzymatique, substitution nucléophile avec rétention totale de configuration, ortholithiation diastéréosélective) et la manipulation des phosphines sous atmosphère inerte, la XYLIPHOS est produit industriellement, à l’échelle de la centaine de kilogrammes, dans des réacteurs de 2500L. Cette diphosphine, associée à l’iridium, catalyse une étape clé d’hydrogénation asymétrique de doubles liaisons C=N dans la synthèse du (R)-Métolachlore. La capacité de production est actuellement de plus de 10000 tonnes par an (schéma I.15).
Notons également l’utilisation de la JOSIPHOS dans un procédé catalytique industriel. Ce ligand22, associé au rhodium, est utilisé pour la synthèse d’un médicament : la (+)-Biotine24 (schéma I.16), dont l’étape clé est l’hydrogénation asymétrique d’une double liaison C=C.
Les diphosphines stéréochimiquement dynamiques.
Depuis les années 1990, une approche différente de la catalyse asymétrique a vu le jour. Des applications récentes ont été décrites, n’utilisant plus uniquement des ligands chiraux énantiomériquement purs et stéréochimiquement rigides, mais également des ligands méso ou achiraux sans dédoublement préalable dans des applications en catalyse asymétrique..
L’idée est d’associer, sur un centre métallique, un ligand méso ou achiral L et un ligand énantiopur L* pour former un complexe [M(L*)(L)]. Le degré d’interaction entre le ligand chiral et le ligand méso ou achiral dépendra de leur nature et de leur proximité au sein du complexe. Les conformations énantiomères du ligand L dans le complexe [M(L)] deviendront alors diastéréoisomères dans le complexe [M(L*)(L)], et différeront donc en énergie. Si cette interaction est forte, alors le ligand énantiopur L* pourra influer sur la conformation prise par L pour qu’il adopte préférentiellement une conformation chirale26 (schéma I.17).
La conformation du ligand L pourra alors participer, ou même jouer un rôle prépondérant, dans la transmission de la chiralité du catalyseur vers le substrat.
L’avantage de cette approche de la catalyse asymétrique, par rapport à l’approche traditionnelle, est l’optimisation du catalyseur par la synthèse de ligands méso ou achiraux, et non plus par la synthèse de ligands énantiopurs. En général, ce type de ligands est plus facile à préparer et moins onéreux.
Le BIPHEP.
Le ligand BIPHEP27 est un ligand analogue à la BINAP qui présente différents conformères dus à la libre rotation autour de l’axe carbone-carbone (ligand tropos28). En effet, la barrière de rotation autour de l’axe C-C est de 22 kcal.mol-1 à 125°C dans le ligand libre. Une telle barrière n’est pas suffisante pour permettre un dédoublement à température ambiante. Il est donc considéré en équilibre conformationel dynamique. En règle générale, les biphényles disubstitués ne peuvent être dédoublés qu’en présence de groupements encombrants en ortho, ou d’un pont reliant les positions 2 et 2’29 ; la barrière de racémisation est alors fortement dépendante de la nature de ce pont.
Table des matières
Introduction générale.
CHAPITRE I : Introduction bibliographique : diphosphines chirales, méso ou achirales, applications en catalyse asymétrique
I. INTRODUCTION
II. LES DIPHOSPHINES STEREOCHIMIQUEMENT RIGIDES
II.1. Diphosphines comportant un seul type de chiralité
II.1.a. Les diphosphines à chiralité centrale portée par les carbones
II.1.b. Les diphosphines à chiralité centrale portée par les phosphores
II.1.c. Les diphosphines à chiralité axiale
II.1.d. Les diphosphines à chiralité planaire
II.2. Diphosphines combinant plusieurs éléments de chiralité
II.3. Conclusion
III. LES DIPHOSPHINES STEREOCHIMIQUEMENT DYNAMIQUES
III.1. Le BIPHEP
III.2. La NUPHOS
III.3. Les diphosphines métallocéniques
III.3.a. Le DPPF
III.3.b. Les bis(phospholyl) métallocéniques
III.4. Les nouvelles diphosphines stéréodynamiques
III.5. Conclusion
IV. UN LIGAND PARTICULIER : LE BIPHOS
IV.1. Première méthode de synthèse
IV.2. Deuxième méthode de synthèse
IV.3. Etude stéréochimique
IV.4. Structure du BIPHOS à l’état solide
IV.5. Structure du BIPHOS en solution
IV.6. Complexation et catalyse
III.7. Conclusion
CHAPITRE II : Synthèse et caractérisation des ligands à motif 2,2’- biphosphole.
I. INTRODUCTION
II. SYNTHESE DES DIPHOSPHINES A MOTIF 2,2’-BIPHOSPHOLE
II.1. Synthèse générale
II.2. Etude structurale et stéréochimique de ces disulfures
III. SYNTHESE DES DIPHOSPHINITES A MOTIF 2,2’-BIPHOSPHOLE
III.1. Synthèse
III.2. Etude structurale
IV. CONCLUSION
V. PARTIE EXPERIMENTALE
CHAPITRE III : Diphosphines et diphosphinites dérivés du 2,2’- biphospholes : stéréochimie, isomérisation et complexation
I. INTRODUCTION
II. ETUDE STEREOCHIMIQUES DES LIGANDS DERIVES DU 2,2’-BIPHOSPHOLE
II.1. Etude stéréochimique
II.2. Calculs théoriques
II.2.a. Cas des diphosphines
II.2.b. Cas des diphosphinites
III. PROCESSUS D’ISOMERISATION.
III.1. Diphosphines stéréorigides ou stéréodynamiques ?
III.2. Etude cinétique.
III.3. Diphosphinites stéréorigides ou stéréodynamiques ?
IV. COMPLEXES DE METAUX DE TRANSITION DES LIGANDS A MOTIF 2,2’-BIPHOSPHOLE.
IV.1. Rappels bibliographiques.
IV.2. Complexes du palladium.
IV.2.a. Cas des diphosphines.
IV.2.b Cas des diphosphinites.
IV.3. Complexes du platine.
IV.3.a. Cas des diphosphines.
IV.3.b. Cas des diphosphinites.
IV.4. Complexes du rhodium.
IV.5. Conclusion.
V. CONCLUSION.
VI. PARTIE EXPERIMENTALE.
CHAPITRE IV : Evaluation des ligands 2,2’-biphospholes en catalyse asymétrique.
I. INTRODUCTION.
II. RAPPELS BIBLIOGRAPHIQUES.
II.1. Le BIPHOS en catalyse.
II.1.a. Hydrogénation.
II.1.b. Hydroformylation.
II.1.c. Substitution allylique.
II.2. Les diphospholes chiraux en catalyse asymétrique.
II.2.a. Hydrogénation.
II.2.b. Hydroformylation.
II.2.b.i. Complexes du rhodium.
II.2.b.ii. Complexes du platine.
II.2.b.iii. Ligands greffés sur support polymérique.
II.2.c. Alcoxycarbonylation.
II.3. Conclusion.
III. SUBSTITUTION ALLYLIQUE.
III.1. Généralités.
III.2. Substitution allylique de l’acétate du 1,3-diphénylprop-2-ényle.
III.3. Evaluation des ligands diphosphines et diphosphinites dérivés du 2,2’-biphosphole.
III.3.a. Cas des diphosphines.
III.3.b. Cas des diphosphinites.
III.3.c. Conclusion.
IV. HYDROFORMYLATION.
III.1. Introduction.
III.2. Evaluation des ligands diphosphines et diphosphinites dérivés du 2,2’-biphosphole.
III.2.a. Cas des diphosphines.
III.2.b. Cas des diphosphinites.
III.2.c. Conclusion.
V. HYDROGENATION.
IV.1. Généralités.
IV.2. Evaluation des ligands diphosphines et diphosphinites dérivés du 2,2’-biphosphole.
IV.2.a. Cas des diphosphines.
IV.2.b. Cas des diphosphinites.
IV.2.c. Conclusion.
VI. CONCLUSION.
VII. PARTIE EXPERIMENTALE.
Conclusion générale
Annexes
ANNEXE 1 : Appareillages, techniques, solvants et réactifs. A1
ANNEXE 2 : Structure des composés II.5.2a, II.5.4a et II.5.6a. A2
ANNEXE 3 : Données cristallographiques. A3