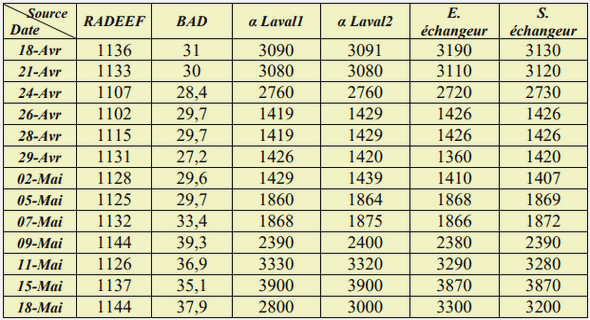
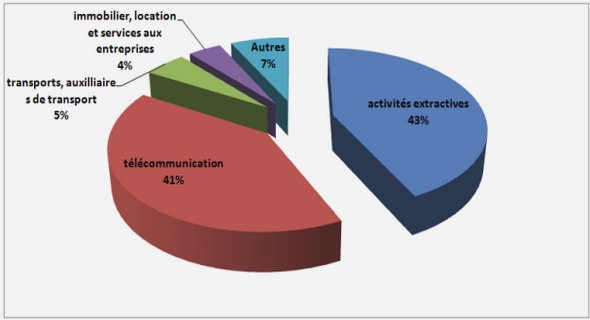
Indicateurs de performance dans la réalisation des études
Le nombre moyen de patients par étude en France passe de 23 à 34, dans pratiquement la même proportion que l’Espagne qui passe de 29 à 43, le Royaume-Uni passe de 29 à 27, l’Italie de 27 à 29. L’Allemagne et l’Europe de l’Est restent en tête pour l’Europe (49 patients par étude contre 38 et 42, respectivement en 2014).
Le nombre moyen de patients en France par étude et par centre est de 5,8. La France devance le Royaume-Uni (3,9), l’Allemagne (4,1), l’Italie (4,6), l’Espagne (5,2), les Etats-Unis (4,7) mais non l’Europe de l’Est (6,2).
La vitesse moyenne de recrutement en France par étude est de 2,6 patients par centre et par mois en 2016, loin devant le Royaume-Uni (0,9), l’Espagne (1,5), l’Europe de l’Est (1,5), l’Allemagne (1,4) et l’Italie (1,6) et les Etats-Unis (0,8).
La proportion de patients recrutés en Europe de l’Est rapportée au nombre total de patients recrutés dans les essais impliquant la France, est de 21 % en 2016 contre 22 % en 2014, une stabilité qui confirme l’importance de l’Europe de l’Est dans la compétition pour les études cliniques.
Au Royaume Uni
En raison de quelques alertes publiques entre 1950 et 1960, plus de 200 Comités d’Éthique locaux se sont développés partout au Royaume-Uni afin de localement répondre aux questions sur les essais cliniques. Le NHS met réellement en place les REC en 1991, suite à la publication des instructions du UK Health Department (Ministère de la Santé du Royaume- Uni), connu sous le nom The Red Book.
Cependant, face à la multiplicité des dossiers de demande d’AEC auprès des REC (1 dossier par site d’investigation), le Ministère de la Santé met en place des REC multicentriques en 1997. Chacun était responsable d’une région et examinait les demandes d’autorisation de plusieurs sites.
Cette volonté de standardiser a été assez mal accueillie par les REC locaux qui souvent refusaient les EC autorisés par les REC multicentriques. En 2000, afin de palier à ces tensions, le Ministère de la Santé britannique a créé le Central Office for Research Ethics Committees, un nouvel organisme responsable de la coordination de tous les RECS.
Le Royaume-Uni compte 90 REC dont 7 au Pays de Galles, 9 en Écosse et 2 en Irlande du Nord. Ils sont souvent basés dans les hôpitaux locaux et constitués de
professionnels de santé, de patients, d’avocats et de membres du public n’ayant aucun lien avec le milieu médical. (52) (53)
Le Royaume Uni est un des pays hébergeant le plus grand nombre d’essais cliniques.
En effet, de 2005 à 2011, il se range à la 5ème position avec 313 demandes.
En 2014, d’après le MHRA, le nombre de demandes a atteint le quota de 760. Ces chiffres s’expliquent par son savoir-faire en management des essais cliniques. Il excelle particulièrement dans la réalisation de la phase 1. En effet, (Clinical trials submitted in marketing-authorization applications to the European Medicines Agency Overview of patient recruitment and the geographical location of investigator sites Containing data from 2005 to 2011 EMA 2013) le pays pilote le plus grand nombre d’essais cliniques de phase 1 depuis 2013 mais est cependant moins performant en matière de phase 3. (54)
L’impact du Brexit : Bien que le Royaume-Uni a déjà son propre dispositif règlementaire encadrant les études cliniques et les autorisations de mise sur le marché, la perte possible de l’accès à la procédure d’enregistrement centralisée auprès de l’EMA risque de ralentir l’accès au marché en pesant sur les capacités de revue de dossiers du MHRA (« Medicines and Healthcare products Regulatory Agency »).
Par ailleurs, l’intégration dans des études cliniques pan-européennes pourrait devenir plus difficile et nécessiter la mise en œuvre d’études cliniques spécifiques pour l’enregistrement au Royaume-Uni.
Enfin, le siège actuel de l’EMA basé à Londres pourrait être relocalisé hors du Royaume-Uni. (55)
Avec une nation de seulement 60 millions d’habitants en comparaison à l’Europe qui en compte 500 millions, l’attractivité du Royaume Uni va être réduit s’il ne fait pas partie de l’EEE. En quittant l’UE, les données cliniques britanniques seront interprétées comme des données auxiliaires, supportant uniquement les données obtenues à travers les essais menés en Europe.
Ainsi la gestion et la localisation des essais cliniques seront tournées vers un autre pays avec un niveau de compétence similaire. Les industries pharmaceutiques vont donc favoriser la réalisation des essais cliniques dans d’autres états membres qui leur permettent d’accéder à un marché plus large.
Cette pénurie sera au détriment des britanniques qui n’auront plus accès aux médicaments expérimentaux dans le cadre des essais cliniques. Certains patients atteints de maladies graves et rares auront plus de difficultés à participer aux études dont les essais représentent un espoir de survie.
PAYS EMERGENTS : BRICS
Les BRICS sont cinq puissances régionales qui jouent un rôle de moteur économique et qui ont des ambitions continentales. L’une d’elles, la Russie, a la particularité d’être un ancien pays du « Nord » effondré par la transition brutale du communisme au capitalisme sauvage, on peut parler d’un pays « ré-émergent ». Le groupe des BRICS ne compte que 5 pays, mais près de la moitié de la population mondiale (dont les deux pays les plus peuplés), et un quart du PIB mondial en PPA (dont le 2e et le 3e PIB mondial). Trois de ces pays sont des puissances nucléaires actuelles. (46) Malgré leurs diversités économiques et culturelles, les BRICS, sont confrontés à des difficultés de soins de santé identiques, y compris l’accès aux services de soins et aux médicaments, des coûts de santé en hausse, des maladies infectieuses comme le VIH et la tuberculose ainsi que la prévalence croissante des maladies non transmissibles.
Brésil
Le Brésil a vu une croissance importante de son marché pharmaceutique ces dernières années, atteignant 20% en 2008. Ses caractéristiques sont la concurrence croissante des médicaments génériques, le fort taux de population urbaine (85%), l’accès aux médicaments grâce à une large couverture d’assurance maladie publique et la présence d’assurances maladies privé es supplémentaires.
Une autre caractéristique importante de cette population est sa diversité ethnique et son métissage, résultat de trois grandes vagues d’immigration qui ont touché le pays au fil des siècles.
La première vague d’immigration a eu lieu au XVIème siècle avec l’arrivée des colons portugais. Différentes tribus d’Indiens peuplaient alors le Brésil : les populations vivant en zone côtière se sont mélangées aux colons à l’inverse des tribus localisées dans l’arrière-pays.
A partir de la moitié du XVIème siècle, le métissage s’est accentué avec l’arrivée de nombreux esclaves africains originaires majoritairement du Nigéria et du Bénin et destinés à travailler dans les plantations ou dans les mines du pays.
Enfin, la troisième grande vague d’immigration a eu lieu à la fin du XIXème siècle (majoritairement portugaise) et au début du XXème siècle. Cette dernière vague venait principalement d’Italie, Allemagne, Espagne, Pologne, Liban, Syrie, Ukraine, Japon, Chine et Corée. (59) Cette immigration était motivée par des raisons économiques ou par la guerre. On pourra noter que c’est désormais au Brésil que se trouve la plus grande communauté japonaise dans le monde après le Japon.
Cette diversité ethnique et raciale qu’on peut classer en différents groupes (amérindien, européen, africain et asiatique) a une répartition hétérogène au niveau géographique et le pays peut être divisé en différentes régions en fonction de l’ethnie de ses habitants.
La Constitution de 1988 a imposé à l’Etat d’assurer un accès universel et égal pour tous les habitants du pays aux services de santé en affirmantque « tout le monde a droit à la santé et que l’Etat a le devoir de l’assurer, à travers des politiques sociales et économiques visant la réduction du risque de maladie et d’autres atteintes à la santé, ainsi que l’accès égalitaire et universel à des actions de promotion, de protection et de recouvrement de la santé » (60).
En 1990 a donc été créé pour plus de 180 millions de brésiliens le Système Unifié de Santé (Sistema de Saú de Único) également appelé SUS. Ce système public de santé géré par le gouvernement repose sur deux principes :
• L’accès gratuit et universel aux services publics de santé dans les hôpitaux publics ou privés ayant passé des contrats de prestation de services avec le Ministère de la Santé. En 2003, on dénombrait près de 6 000 hôpitaux dont 60% étaient privés. On notera que ces hôpitaux se situent dans les grandes zones urbaines indépendamment de leur statut public ou privé.
• L’élargissement de la compétence et de l’autonomie dans la gestion et le contrôle des programmes de santé par les différents acteurs politiques (collectivités locales, états fédérés et municipalités).
La création de ce système a été une grande avancée pour la population brésilienne : en effet près de ses deux tiers (principalement les plus défavorisés) dépendent de ce système pour recevoir un traitement médical, le SUS s’étendant du simple soin ambulatoire à la transplantation d’organes.
Les populations plus aisées font appel, quant à elles, à des sociétés d’assurances santé privées (planos de saudé ).
En conclusion, le Brésil est un vaste pays dominé par des disparités géographiques et économiques,mais son système de réglementation concernant la santé est l’un des plus élaborés d’Amérique du Sud.
Le pays est proche des compagnies pharmaceutiques américaines et canadiennes comparé à d’autres pays émergents, notamment ceux d’Asie.
Russie
Cette partie se base sur une enquête menée en 2013 par l’association suisse indépendante : la Déclaration de Berne. (62) Alors que les premiers essais cliniques de médicaments menés en Russie remontent au début des années 1990, c’est seulement à partir de 1997 que leur nombre a notablement augmenté, triplant quasiment d’une année à l’autre.
En 2011, 33% des médicaments autorisés par la FDA US, et 48% de ceux homologués par l’EMA reposaient sur des données générées par des recherches cliniques en Russie et en Ukraine.
En 2012, 916 nouveaux essais cliniques ont été approuvés par le Ministère de la Santé Russe, tous types confondus, soit une augmentation de 60% par rapport à l’année précédente.
En Russie, les patients sont parfois recrutés pour des essais cliniques par leur médecin habituel (dans ce pays, les consultations sont gratuites et les médecins sont « attribués » selon le domicile du patient), qui leur propose de participer à une étude en guise de traitement standard.
La deuxième option : le recrutement se fait via des formulaires sur internet (sites internet des hôpitaux, forums etc.). Le patient peut aussi entrer en contact avec l’hôpital ou le médecin-investigateur de son propre chef. Le formulaire de consentement éclairé lui est donné pour quelques jours. Si le patient accepte de participer, il est obligé de se rendre fréquemment à l’hôpital pour des prélèvements de sang et autres examens. Le promoteur de l’essai a l’obligation de payer une assurance médicale pour chaque participant (selon l’Arrêté du gouvernement russe du 13 septembre 2010.
L’Inde
L’Inde est devenue une destination préférée pour les essais cliniques avec presque 20 à 30% des activités mondiales.
De nombreuses raisons expliquent cet accroissement : près de la moitié du coût d’exploitation, faible coût par patient, des professionnels de santé anglophones et qualifiés, grand pool de patients avec des sujets avec de grandes diversités ethniques, des institutions bien équipées technologiquement. Un recrutement facile et rapide.
Cependant, cette tendance conduit à des cas de consentements éclairés insuffisants et un traitement contraire à l’éthique.
Les études pré-cliniques et cliniques sont ainsi controlées en vertu de règlement strict du gouvernement dans la plupart des pays, conformément aux guidelines internationales à l’éthique et à la réglementation locale