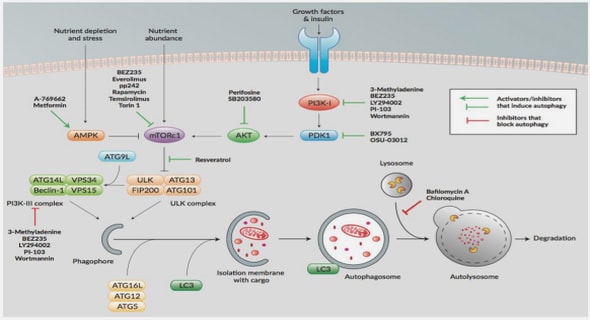
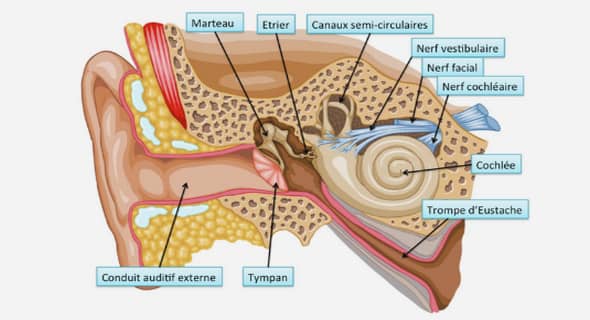
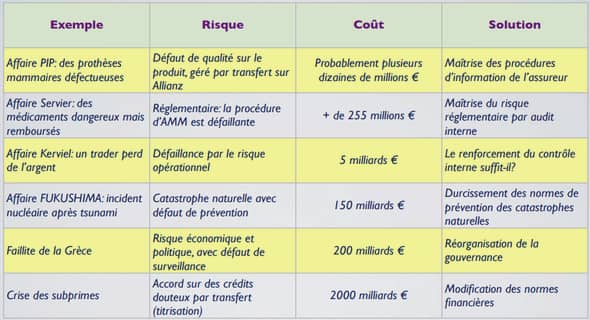
EXTRAIT TOTAL A L’ETHER DE FEUILLES DE LPP-02-16 (ANNONACEAE)
Médicaments analgésiques
Rappels sur les antalgiques Les analgésiques ou antalgiques sont des médicaments capables d’abolir ou de diminuer la perception de la sensation douloureuse sans toucher aux autres sensibilités. Ces analgésiques peuvent être classés de différentes manières : Selon leur lieu d’action : analgésiques à action centrale qui agissent aussi bien au niveau du système nerveux central que périphérique ; analgésiques à action périphérique qui n’agissent qu’au niveau périphérique. Selon leur nature : analgésiques morphiniques qui ont une grande puissance d’action et sont toxicomanogènes ; analgésiques non morphiniques qui ont une puissance d’action moindre et ne sont pas toxicomanogènes. Selon L’OMS : c’est une classification des antalgiques en trois paliers ou niveaux. Cette échelle permet une hiérarchie des analgésiques en fonction de leur niveau de puissance et de leurs rapports avantages/inconvénients. Même si elle a été élaborée dans le cadre de la prise en charge de la douleur cancéreuse, elle permet à tout praticien de se référer à une classification opérationnelle dès lors qu’il doit traiter une douleur sur le plan symptomatique. Cette échelle se définit comme suit [32,33] : Niveau 1 : analgésiques non morphiniques, appelés aussi analgésiques périphériques ou mineurs. Ils sont représentés par le paracétamol, l’aspirine et les antiinflammatoires non stéroïdiens (AINS) ; Niveau 2 : agonistes morphiniques faibles. Le niveau 2 est souvent constitué par des associations entre analgésiques de niveau 1 et analgésiques morphiniques faibles : paracétamol et codéine ; paracétamol et tramadol Niveau 3 : regroupement des agonistes morphiniques forts (morphine) et des agonistes-antagonistes (pentazocine et nalbuphine).
Antalgiques non opioides (Palier I)
Par opposition aux opiacés des paliers 2 et 3, les médicaments antalgiques du palier 1, ne dérivant pas de l’opium, sont donc des non opioïdes. Ils sont représentés principalement par des antalgiques dits périphériques car ils exercent essentiellement leur action en périphérie au niveau des tissus lésés. Ils sont très largement utilisés pour traiter les douleurs d’intensité légère. Ils inhibent pour la plupart la synthèse des prostaglandines responsables de l’inflammation et de la douleur, en inhibant les cyclo-oxygénases qui interviennent dans la transformation de l’acide arachidonique. Les antalgiques non opioïdes peuvent être associés aux antalgiques opioïdes (niveaux 2 et 3 OMS). La compréhension de leur mécanisme d’action est indissociable de la physiologie des prostaglandines. Souvent banalisés dans l’esprit des malades, ils font l’objet d’une automédication parfois sauvage alors qu’ils exposent à de nombreux effets indésirables, prostaglandines dépendants ou non. I.2.1 L’acétaminophène ou paracétamol [34] Le paracétamol est un des métabolites actifs de la phénacétine appartenant à la famille chimique des para-aminophénols. Pharmacocinétique Les caractéristiques essentielles de la pharmacocinétique du paracétamol sont les suivantes : Administration par voie orale (per os) : Résorption digestive rapide et complète. Diffusion dans l’organisme bonne. Pic de concentration plasmatique : 30 min à 60 min après la prise. une faible liaison aux protéines plasmatiques (10 %), ce qui exclut les risques d’interactions liés à cette propriété ; Une excrétion rénale importante (90 %) ; Demi-vie vie courte : 2-3 heures. Métabolisme hépatique : fabrication de métabolites réactifs (par le cytochrome P450) c’est le N-acétyl-parabenzoquinone- imine. La Détoxification par le glutathion contenu dans les cellules hépatiques, de ces métabolites réactifs, potentiellement hépatotoxiques pouvant entraîner une nécrose 39 Thèse de Doctorat d’Exercice en Pharmacie hépatique aiguë potentiellement mortelle en cas de déficit en glutathion. C’est là le facteur limitant à l’augmentation des doses de paracétamol. Pharmacodynamie Plus de cent ans après sa mise sur le marché, le mécanisme de l’action antalgique du paracétamol reste toujours mal connu. C’est un inhibiteur de la cyclo-oxygénase cérébrale de type 3 (COX-3). Par ailleurs, des travaux déjà anciens de Flower et Vane ont démontré que le paracétamol possède un effet inhibiteur quasi inexistant des cyclo-oxygénases périphériques alors que les enzymes centrales seraient plus fortement inhibées. Du fait qu’il n’a pratiquement pas de propriétés anti-inflammatoires, Il n’a pas non plus les effets indésirables qui sont liés à cette propriété. C’est ce qui fait que, comme antalgique ou comme antipyrétique, il est largement préféré à l’aspirine, surtout chez l’enfant, chez les hémophiles et en cas d’antécédents d’ulcère gastro-duodénal. D’autres travaux évoquent un mécanisme d’action central impliquant le système sérotoninergique central. [35] Indications, Contre-indications et Précautions d’emploi Le paracétamol est un antalgique à utiliser dans les douleurs d’intensité faible à modérée. Il est contre-indiqué en cas d’antécédent d’hypersensibilité au paracétamol et d’insuffisance hépato-cellulaire. Il existe un antidote, qui aide à reconstituer les réserves de glutathion et qui doit être donné précocement en cas de surdosage : la N-acétylcystéine
Anti–Inflammatoire Non Stéroïdiens (AINS)
L’acide acétylsalicylique ou l’aspirine est le plus ancien des AINS, découvert empiriquement à partir de l’écorce de saule. Les autres AINS employés comme analgésiques sont constitués essentiellement par des dérivés anthraniliques tels que l’acide méfénamique et des dérivés propioniques comme l’ibuprofène, le fénoprofène. L’emploi d’un AINS comme antalgique, fréquent dans les automédications, impose de bien peser le rapport bénéfices/risques en raison d’une pharmacovigilance riche. Cette partie sera plus abordée dans le chapitre suivant.
Autres analgésiques périphériques
La phénacétine et la noramidopyrine La phénacétine et la noramidopyrine ne sont plus utilisées en raison respectivement du risque de néphropathie interstitielle chronique et du risque d’agranulocytose immuno-allergique. La floctafénine (IDARAC®) La floctafénine est la seule molécule du groupe des fénines qui reste sur le marché aujourd’hui. Les autres, en particulier la glafénine en ont été retirés en raison d’insuffisance rénale et de choc anaphylactique. Ce dérivé de l’amino-4-quinoléine est un antalgique pur, sans action antipyrétique ni antiinflammatoire. Le néfopam (ACUPAN®) Ce dérivé de la benzoxazocine possède une structure chimique non apparentée à celle des antalgiques connus actuellement. Ce n’est théoriquement pas un médicament de première intention, cependant il est beaucoup utilisé en première intention en médecine générale à l’Hôpital. C’est un analgésique antipyrétique, possède une action centrale, il inhiberait la recapture des catécholamines et de la sérotonine. Son mécanisme d’action le rapproche des antidépresseurs tricycliques. [35] Autres Classes Thérapeutiques Utilises Dans Le Traitement De La Douleur Les Glucocorticoïdes : ce sont de puissants antalgiques, ils sont recommandés dans les douleurs liées à une compression tumorale ou à l’œdème inflammatoire. Ils sont aussi préconisés dans les céphalées secondaires à une HTA crânienne, névralgie sciatique etc. Les Antispasmodiques : ils sont indiqués dans les coliques ou spasmes viscéraux provoqués par un cancer colique ou ovarien. Les Antibiotiques : ils sont indiqués dans les infections profondes secondaires aux tumeurs et dans les douleurs d’origine pleurale. Les Tranquillisants : ils peuvent être associés à la morphine administrée per os ; ils permettent d’atténuer la composante anxieuse liée à la douleur. On utilise : – Les neuroleptiques : chlorpromazine, halopéridol etc. – Les benzodiazépines : diazépam, lorazépam etc. Ce sont des co-antalgiques de choix lorsque la douleur est accompagnée d’anxiété, d’insomnie ou de contracture 41 Thèse de Doctorat d’Exercice en Pharmacie Les Antiépileptiques : la carbazépine et la phénytoine sont efficaces dans le traitement des douleurs spécifiquement neurologiques, de type paroxystique, comme la névralgie du trijumeau. I.3 Les antalgiques opioides [36] Les opioïdes exercent leurs effets en agissant sur des récepteurs morphiniques spécifiques. Les récepteurs des opiacés sont des récepteurs métabotropes à 7 hélices transmembranaires et couplés aux protéines G. Leur activation conduit habituellement à une hyperpolarisation du neurone sur lequel ils se trouvent, par l’intermédiaire de canaux calciques et potassiques. Ces récepteurs sont de trois types : les récepteursμ, dont l’activation induit l’analgésie, l’euphorie, la sédation, la dépendance physique, le myosis, la dépression respiratoire, et la diminution de la mobilité du tractus gastro-intestinal ; les récepteursδ, dont l’activation induit l’analgésie, la dépression respiratoire, et la dépendance physique ; les récepteurs κ, dont l’activation induit l’analgésie, la sédation, le myosis ou encore l’inhibition de la libération de l’hormone antidiurétique. À chaque type de récepteurs correspond une famille d’opioïdes endogènes. Les opioïdes ont une structure stéréochimique qui s’adapte à ses récepteurs. L’action prédominante des opioïdes se situe au niveau des membranes des fibres nociceptives où ils modifient les courants ioniques transmembranaires. Ils agissent ainsi directement sur la libération des neurotransmetteurs et inhibent la transmission synaptique. Ces récepteurs μ, δ et κ sont divisés en sous-types (μ1, μ2…), qui proviennent de l’épissage alternatif des gènes codant pour ces récepteurs.
Classification des opioïdes
Les opioïdes peuvent être classés selon leur puissance d’action. On distingue alors les antalgiques de palier 2 (la codéine, le tramadol ou la dextropropoxyphène retiré du marché en mars 2011, etc.) et les antalgiques de palier 3 (la morphine, la péthidine, l’hydromorphone, etc.). Cette classification sera utilisée pour la suite de la présentation des antalgiques opioïdes. Mais de façon plus courante, les antalgiques opioïdes sont classés en fonction de leur action sur les récepteurs, en trois catégories : 42 Thèse de Doctorat d’Exercice en Pharmacie les agonistes purs : ont un effet plafond tardif et ne réduisent pas les effets d’autres agonistes donnés simultanément. Certains sont nettement moins puissants que la morphine, comme le dextropropoxyphène, la codéine, la dihydrocodéine, et le tramadol. les agonistes partiels / antagonistes : La buprénorphine est actuellement le seul agoniste partiel des récepteurs μ et antagoniste des récepteurs κ, utilisé en clinique. Son affinité pour les récepteurs est forte, ce qui explique la lente dissociation de ceuxci, son action prolongée, et la difficulté à antagoniser ses effets par la naloxone. les agonistes / antagonistes : La nalbuphine est actuellement le seul agoniste des récepteurs κ et antagoniste des récepteurs μ, possédant un effet plafond, et qui ne doit pas non plus être associé aux agonistes purs. Son effet peut être reversé par la naloxone. Les antagonistes purs : La naloxone (NARCAN®) est le seul antagoniste pur, mais n’est pas un médicament antalgique. Il s’oppose à tous les effets de la morphine et est utilisée comme antidote. Nb : les opioïdes sont capables de réduire certaines douleurs intenses, toutefois la prescription d’un opioïde reste entachée de la crainte de voir se développer un phénomène de tolérance, conduisant à augmenter chaque fois la dose du produit pour obtenir le même effet analgésique et /ou rendre le patient dépendant à cette substance.
INTRODUCTION |