ETUDE ELECTROCHIMIQUE DES METAUX DANS UNE MATRICE SOLIDE
Historiques des électrodes à pâte de carbone
C’est en 1958 que Ralph Norman Adams (Université de Kansas à Lawrence, USA) a eu l’idée de concevoir un dispositif analytique pour pallier les limites des électrodes à base de mercure [1]. Les méthodes électrochimiques à base de mercure ont construit leur renommée sur leur capacité à réaliser des études sélectives, sensibles et reproductibles de cations métalliques dans des plages de potentiels inférieurs à 0,789 V/ENH (pour le couple Hg2+/Hg), le mercure n’étant plus thermodynamiquement stable au-delà de ce potentiel. D’où l’idée de remplacer ce métal par des électrodes à même de s’affranchir de cette limitation. Le carbone est un bon composé pour cet objectif, parce qu’il est à la fois bon conducteur électronique et quasi inerte électrochimiquement. Il permettrait par conséquent d’obtenir des domaines d’électroactivité largement plus étendus. Le concept originel, inspiré de l’électrode à gouttes de mercure tombantes (DME), prévoyait de préparer une suspension en mélangeant de la poudre de carbone (graphite) avec un liquide organique approprié dans un réservoir. Ce dernier serait relié à un capillaire permettant d’obtenir des gouttes de carbone et par conséquent de renouveler aisément la surface de l’électrode en changeant de goutte, comme c’est le cas avec le mercure. Toutefois, la mise en œuvre de cette idée de départ n’a pas fourni les résultats escomptés, et l’une des causes avancées pour expliquer cet échec est la présence d’une grande quantité de liquide, entraînant une résistance électrique élevée [2]. Néanmoins, les travaux poursuivis par l’équipe du fondateur, ont conduit à l’obtention d’une pâte dont les caractéristiques sont en adéquation avec les propriétés initialement souhaitées par Adams : c’est la naissance de la pâte de carbone comme matériau d’électrode telle que nous la connaissons de nos jours. Elle est en fait constituée d’un mélange de poudre de carbone (ou graphite) et d’un liquide organique appelé liant, suivant un ratio adéquat. 8 Depuis lors, beaucoup de travaux ont été entrepris pour, d’une part, la caractérisation de la pâte et, d’autre part, son utilisation à des fins analytiques. Il en a résulté que les deux constituants de base de la pâte, à savoir la poudre de carbone et le liant doivent posséder un certain nombre de qualités et de propriétés intrinsèques.
La poudre de carbone et ses propriétés
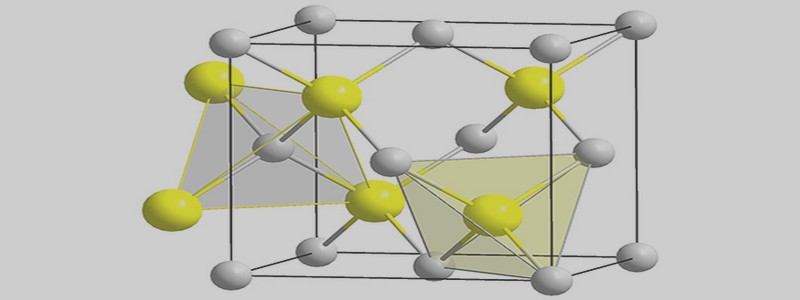
Grâce à sa structure électronique particulière [1s²_2s²_2p²] et ses orbitales atomiques capables de s’hybrider avec d’autres atomes de carbone ou des hétéroatomes, le carbone, élément essentiel à la vie, se trouve dans beaucoup de combinaisons chimiques ou biochimiques. La seule forme thermodynamiquement stable du carbone est le graphite hexagonal [3]. Il est obtenu par pyrolyse du carbone à 3000° C. L’une des propriétés intrinsèques qui motive le choix du carbone pour concevoir des électrodes est sa capacité à conduire des charges électriques. Figure 1. 1 – Poudre de carbone Les poudres de carbone utilisables dans la préparation de la pâte sont diverses. La poudre de graphite spectroscopique est la plus répandue, Švancara et al [4] l’estiment entre 80-90% des types de carbone utilisés dans les pâtes pour électrode. D’autres variétés sont également recensées, dont certaines sont parfois employées comme agent de modification de la pâte. Il s’agit, entre autres, de la poudre de carbone vitreux [5] qui a été introduite en 2001 [6], du noir de carbone (acetylene black) [7–9], du fullerène [10,11], des nano-fibres de carbone [12] ainsi que les nanotubes de carbone (CNTs). Ces derniers se subdivisent en deux variantes, les 9 nanotubes multifeuillets ou multiparois (Multi-Wall Carbon-Nanotubes, MWCNT), découverts en 1991 et les nanotubes monofeuillets ou monoparois (Single-Wall CarbonNanotubes, SWCNT), découverts en 1993. Ils suscitent un grand intérêt grâce à leurs propriétés uniques [13]. Outre leur haute finesse (diamètre de l’ordre du nanomètre) et leurs très bonnes stabilités chimique et mécanique, les nanotubes ont une conductivité électrique comparable à celle des métaux, des semi-conducteurs et même des supraconducteurs [13,14]. Ils ont également une grande surface spécifique (large rapport surface/volume) et une forte capacité d’adsorption [15]. Autant de propriétés qui permettent d’améliorer considérablement les performances analytiques des électrodes à base de carbone. Toutes les variétés de graphite susmentionnées, disponibles chez les fournisseurs spécialisés dans les produits chimiques, peuvent se distinguer par le diamètre des grains qui constituent la poudre. En fait pour être utilisée comme matériel d’électrode, la poudre doit être constituée de particules très fines. Généralement le diamètre de particule varie entre 5 et 20 µm. Outre la taille des particules, la poudre de graphite doit satisfaire aux exigences suivantes [2]: distribution uniforme des graines ; faible capacité d’adsorption pour l’oxygène et les impuretés électroactives ; haute pureté chimique. C’est dire que toute poudre de carbone n’est pas nécessairement un bon matériau d’électrode.
Les Liants
Dans le contexte du présent travail relatif aux EPC, un liant peut être défini comme une substance spécifique dont le rôle principal est de lier mécaniquement les graines de poudre de graphite en les humidifiant, pour former une pâte. Ces substances très souvent liquides, sont répertoriées en plusieurs catégories :
Les liants organiques ou non conducteurs
Les liants non-conducteurs sont les premiers à être utilisés et les plus répandus. Parmi ceux-ci, figurent les huiles de silicone [16,17] et les huiles minérales ou de paraffine [18,19] qui représentent à elles seules plus de 70% des liants utilisés pour préparer des pâtes de carbone [4]. L’huile de silicone est fabriquée à partir de polymères à base de silicium (siloxane : Si–O–Si), alors que celle de paraffine est obtenue lors des opérations de raffinage 10 du pétrole. Le mot paraffine (du latin « parum affinis ») signifie, qui a peu d’affinité. C’est dire que ces huiles n’ont pas de réactivité électrochimique ou chimique, ce qui est l’une des propriétés fondamentales pour être utilisables comme liant. Toutes ces huiles ont les principales propriétés répertoriées par Švancara et al. [4] pour un bon liant organique. Pour ces auteurs, le liant doit : être inerte du point de vu chimique et électrochimique, du moins dans la zone d’électroactivité de l’analyte ; avoir une faible volatilité, pour éviter qu’il ne s’évapore complètement avant de finir l’homogénéisation de la pâte ; avoir une très faible solubilité en milieu aqueux ; être non miscible avec les solvants organiques ; avoir une viscosité élevée. Toutefois, le critère de viscosité élevée doit être relativisé. En effet, dans un article [20] où les effets de la viscosité et de la composition du liant sur la performance d’une EPC ont été examinés, les auteurs ont utilisé une huile de silicone avec des viscosités qui varient sur la plage 10-60000 mPa.s-1 à 25°C. Ils ont rapporté que la viscosité avait un effet non désirable sur l’oxydation directe des phénols et catéchols et que la valeur optimale dans ce cas est de 100 mPa.s-1. Il est également démontré qu’une certaine viscosité pouvait impacter négativement le transfert d’électrons au sein de la pâte. La liste des liants organiques n’est pas exhaustive. A côté de ceux précités, disponibles dans les catalogues des différents fournisseurs, d’autres produits sont utilisés dans des cas rares comme liant [2] : il s’agit des hydrocarbures aliphatiques (hexane, octane, décane, dodecane, hexadécane), des composés aromatiques (benzène, naphtalène, trimethylbenzène, diphényl éther) et des esters (tricrésylphosphates, phtalate de dioctyle). Certains de ces liants ont la propriété de former des complexes avec la substance à analyser. Une catégorie bien particulière de liants organiques est celle des liants « solidifiant » qui se présentent à l’état solide à température ambiante.
Les liants solidifiants
Ce type de liants se présente dans un état solide à température ambiante et ont des températures de fusion relativement basses. Lorsqu’ils sont chauffés à la température de fusion, ils passent à l’état liquide et peuvent dès lors être utilisés avec la poudre de graphite 11 pour former la pâte. Lorsque le mélange se refroidit, il devient compact et donne une « pâte solide» [4]. Certains auteurs homogénéisent la poudre de carbone et le liant solide avant le chauffage du mélange pour obtenir la pâte [21]. Les plus courants de ces liants solides sont : la paraffine solide (paraffin wax) [21,22] et le phénanthrène [23]. Le phénanthrène est un composé formé de trois cycles aromatiques (C14H10). Très peu soluble dans l’eau, il est extrait de l’huile d’anthracène produite par distillation du goudron de houille. Il participe à la formulation des substances conductrices d’électricité utilisées dans les batteries et les cellules solaires [24,25].
Les liants électrolytiques ou conducteurs
Les liants conducteurs sont des solutions électrolytiques, souvent employées dans le cas des pâtes avec un solide électroactif incorporé. Ils peuvent avoir la faculté ou pas de former des complexes avec les ions des éléments incorporés dans la pâte. Le présent travail constitue une illustration des résultats obtenus avec ces types de liant. L’étude détaillée des liants que nous avons utilisés fera l’objet d’un paragraphe spécifique. Ces liquides ont la capacité d’inter-agir (attaquer) et parfois de former des complexes stables avec les ions des métaux incorporés. C’est la raison pour laquelle nous avons travaillé avec des concentrations relativement élevées pouvant aller jusqu’à 2 M. Ces liants sont obtenus par dilution de solutions commerciales d’acides et de bases. Ils sont très adaptés à l’analyse des solides inorganiques (minerais). On utilise essentiellement les acides inorganiques comme l’acide chlorhydrique [26,27], l’acide sulfurique [27,28] et l’acide nitrique [16], mais aussi les solutions basiques telles que l’hydroxyde de sodium [29] ou l’hydroxyde de potassium [30]. Aujourd’hui, une nouvelle gamme particulière de liants conducteurs, qui apporte de nouvelles propriétés est largement investiguée, ce sont les liquides ioniques.
Les liquides ioniques
Les liquides ioniques (LI) sont des sels organiques liquides à la température ambiante, avec une basse température de fusion (< 100°C). Ils sont formés d’un large cation organique asymétrique associé à un anion organique ou inorganique. Connus en chimie comme des solvants prometteurs pour remplacer ceux organiques et pollueurs, les LI sont aussi utilisés en électrochimie dans la conception des batteries. Toutefois, leur première utilisation en électroanalyse, soit comme électrolyte soit comme composante d’une électrode à pâte de 12 carbone remonte à 2005 avec les travaux de Lui et al [31,32] qui montrent que la présence du cation et de l’anion du LI, augmente considérablement la surface spécifique de l’EPC et qu’il se forme également une troisième couche entre la double couche électrochimique électrode/électrolyte. Bien que leur usage comme liant soit récent, les liquides ioniques suscitent beaucoup d’intérêt grâce à leurs propriétés prometteuses dont une haute stabilité chimique et thermique, une faible pression de vapeur, une bonne conductivité électrique et une large fenêtre d’électroactivité. La caractérisation électrochimique des propriétés intrinsèques des LI indique que ces derniers ont une large zone d’électroactivité pouvant atteindre 4,5 V, ce qui représente plus de deux fois celle de la plupart des électrolytes aqueux qui tourne en moyenne autour de 1,2 V [33], voir 2 V dans certains cas [4,26]. Les composés les plus utilisés sont ceux à base du cation imidazolium tels que 1-butyl-3-methylimidazolium hexafluorophosphate [BMIM][PF6], 1-butyl-3-methylimidazolium tetrafluoroborate [BMIM][BF4], 1-octyl-3-methylimidazolium hexaflourophosphate [OMIM][PF6] [31,32,34], et ceux formés par le cation organique pyridinium dont n-octylpyridinium hexafluorophosphate [OPy][PF6] [34–37]. Le choix des LI a été motivé par le désir de trouver des liants conducteurs qui puissent conserver le critère de viscosité et qui permettent d’analyser sur une très large fenêtre électrochimique. Car, il faut le préciser, la viscosité est l’une des caractéristiques de ces liquides dites « solvants verts
Remerciements |