Etude du rôle de la glucosylcéramidase dans le
mélanome cutané
La glucosylcéramidase (ou GCase)
Une enzyme lysosomale du catabolisme des glycosphingolipides
Le lysosome
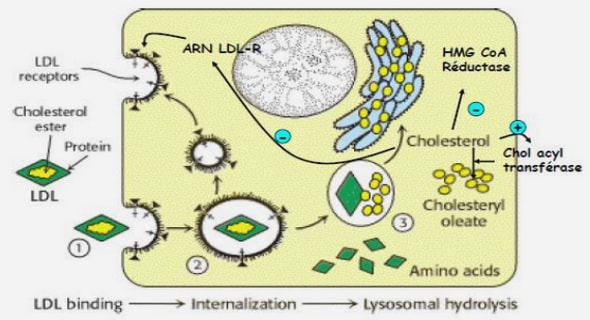
Le lysosome, décrit par Christian de Duve dans les années 50, est un organite cytoplasmique délimité par une membrane dans lequel se déroule la dégradation de macromolécules (protéines, lipides, glucides, acides nucléiques) et de composants cellulaires dont les produits seront ensuite exportés par simple diffusion ou grâce à des transporteurs membranaires spécifiques puis réutilisés pour le métabolisme cellulaire (Kolter and Sandhoff, 2010). Ce catabolisme repose sur l’action de plus de 60 hydrolases acides, des enzymes spécifiques du type de liaison, parfois aidées par des activateurs, dans un environnement acide (pH entre 4.5 et 5), qui est maintenu par l’ATPase vacuolaire membranaire. La membrane lysosomale est caractérisée par de nombreuses protéines membranaires notamment les protéines hautement glycosylées appelées LAMP (Lysosome-Associated Membrane Proteins), des canaux ioniques et des transporteurs assurant l’homéostasie lysosomale. La face cytosolique du lysosome contient des facteurs permettant des interactions avec le reste de la cellule comme les SNAREs qui médient la fusion avec d’autres organites et les facteurs « tethering » ou des connexions facilitant les contacts avec les organites. Cette face est également le siège de phénomène de signalisation notamment avec la liaison au facteur de transcription TFEB (Transcription Factor E Box) (cf. Partie I.A.2). Enfin, la présence d’adaptateurs associés à de petites GTPases est retrouvée couple le lysosome au système des microtubules permettant la mobilité de ce dernier (Figure 1). 21 Figure 1. Le lysosome et ses caractéristiques (Ballabio and Bonifacino, 2020). Les macromolécules à dégrader arrivent aux lysosomes par 2 grandes voies : le système endosomal et le système autophagique. Le système endosomal permet l’internalisation des macromolécules membranaires ou provenant du milieu extracellulaire via l’invagination de la membrane plasmique formant ensuite des endosomes (précoces puis tardifs) fusionnant avec le lysosome. Le système autophagique permet, quant à lui, de délivrer le contenu cytoplasmique aux lysosomes, via la formation d’un phagophore puis d’un autophagosome, une structure constituée d’une double membrane qui englobe les organites ou protéines et qui fusionne in fine avec le lysosome (Kolter and Sandhoff, 2010) (Figure 2).
Maladie de Gaucher
La maladie de Gaucher, due au déficit fonctionnel de la GCase, est une maladie autosomique récessive décrite par Philippe Gaucher (Gaucher, 1882) et serait la plus commune des maladies de surcharge lysosomale (Stirnemann et al., 2017). 1. Epidémiologie La maladie de Gaucher est une maladie rare avec une incidence entre 0,4 et 5,8 sur 100 000 habitants pouvant atteindre 1/800 naissances dans la population juive Ashkénaze et une prévalence variant de 0,70 à 1,75 pour 100 000 habitants (Nalysnyk et al., 2017; Stirnemann et al., 2017). En France, en 2012, l’incidence était de 1 sur 50 000 naissances et la prévalence était de 1/136 000 (Stirnemann et al., 2012). 2. Tableau clinique La maladie de Gaucher présente une hétérogénéité clinique importante. Trois phénotypes cliniques sont définis selon la présence et la sévérité de signes neurologiques.
Type 1 ou forme non neuropathique
Le type 1 représente la forme la plus commune avec une prévalence de 90-95% en Europe et en Amérique du Nord (Stirnemann et al., 2017). La présentation est variable, allant du tableau cliniquement asymptomatique aux formes plus sévères avec un début précoce dans l’enfance. Le type 1 est caractérisé par une hépatosplénomégalie, des cytopénies (anémie et thrombopénie), des anomalies osseuses (déformations osseuses en flacon d’Erlenmeyer, ostéopénie, fractures pathologiques, infarctus osseux, ostéonécrose) et des anomalies pulmonaires mais sans atteinte neurologique. Les patients développent aussi des douleurs chroniques et une fatigue.
Type 2 ou forme neuropathique
Le type 2 représente moins de 5% des patients et se caractérise par une atteinte neurologique sévère et précoce entraînant une neurodégénérescence rapide (débutant généralement entre 3 et 6 mois) (Stirnemann et al., 2017). Les patients meurent généralement dans les 3 premières années de vie. Le tableau clinique est dominé par des signes de neurodégénérescence comme l’arthrogrypose, l’apnée, l’hypertonie, l’hypokinésie, le strabisme pouvant évoluer vers l’épilepsie et l’opisthotonos, des signes d’atteinte bulbaire, et une paralysie oculomotrice supra nucléaire horizontale. L’hépatosplénomégalie et les anomalies cytologiques sont également retrouvées (Weiss et al., 2015). On distingue dans le type 2 les formes périnatales létales : l’hydrops fetalis et le bébé collodion. Ce dernier présente un phénotype cutané particulier dans lequel le nouveau-né est enveloppé dans une membrane rigide, tendue et vernissée ressemblant à une pellicule de collodion séchée. Il s’agit d’un état transitoire, évoluant en quelques semaines vers une ichtyose de forme variable. Cette forme particulière montre le rôle important de la GCase dans la biologie de la peau (cf. Partie I.A.6).
Type 3
Le type 3 présente une atteinte viscérale avec une hépatosplénomégalie et une atteinte neurologique mais contrairement au type 2, cette atteinte débute plus tardivement (8 ans) et est lentement progressive (Stirnemann et al., 2017). La présentation clinique de ce type est très hétérogène. La forme la plus caractéristique présente une atteinte systémique sévère avec une paralysie oculomotrice supranucléaire horizontale avec ou non un retard psychomoteur. Ce large spectre clinique peut rendre le diagnostic difficile avec un risque d’errance et donc de complications. Cependant, le diagnostic positif est relativement accessible et repose sur le dosage de l’activité résiduelle de la GCase et sur l’analyse moléculaire du gène GBA.
Remerciements |