Etude des mécanismes anti-cancéreux induits par
milieux activés par jet de plasma froid
Le plasma en oncologie
On estime à 400 000 le nombre de nouveaux cas de cancers (incidence) et à 150 000 le nombre de décès (mortalité) en 2017 en France56. Les traitements classiquement adoptés à l’heure actuelle sont la chirurgie, la radiothérapie, la chimiothérapie, l’immunothérapie mais de nouvelles solutions sont en cours de développement pour augmenter l’efficacité des traitements anticancéreux et diminuer leurs effets secondaires. La première partie de ce chapitre est consacrée à une brève introduction du cancer et ses caractéristiques, puis les méthodes de traitement plasma en oncologie sont détaillées.
Le cancer
Le cancer est une maladie qui se caractérise par la multiplication et la propagation anarchique de cellules anormales qui, si elles ne sont pas éliminées, vont provoquer plus ou moins rapidement le décès de la personne touchée. Il peut être dû à des facteurs externes tels que le mode de vie ou les facteurs environnementaux, où bien internes comme les mutations héréditaires ou un dérèglement du système immunitaire.
Fonctionnement de la cellule
L’Homme possède des milliards de cellules qui se développent et remplissent une fonction définie, puis meurent de façon programmée. L’organisme fonctionne donc grâce à un équilibre entre la production de nouvelles cellules grâce au mécanisme du cycle cellulaire, la destruction d’autres cellules par apoptose et le mécanisme de mort programmée. Le cycle cellulaire, représenté Figure 2-1, est découpé en 5 phases : • Etat de quiescence (G0) : les cellules attendent un signal pour entrer dans la phase G1. Les cellules peuvent rester plusieurs années dans cet état de quiescence. • Phase de croissance (G1) : les cellules, bien que remplissant l’ensemble des fonctions nécessaire à leur fonctionnement, se préparent à la division cellulaire. La cellule commence à fabriquer des protéines et de l’ARN (agents de l’expression génétique qui traduisent l’information génétique en protéines). Contexte de l’étude – Chapitre 2 – Le plasma en oncologie 48 • Phase de synthèse (S) : l’ADN des cellules est copié, créant ainsi deux paires de chromosomes servant pour chacune de leurs deux cellules filles. • Phase de croissance (G2) : les cellules continuent de fabriquer ARN et protéines en vue de la division. • Phase de division ou mitose (M) : les cellules se divisent en deux cellules filles. La mitose comporte 4 phases appelées prophase, métaphase, anaphase et télophase. Durant ces étapes, les chromosomes se rassemblent à l’équateur de la cellule puis se séparent en chromatides qui vont migrer vers les pôles opposés de la cellule. L’enveloppe nucléaire va ensuite se refermer sur les extrémités de la cellule donnant naissance à deux cellules filles. Figure 2-1 Les phases du cycle cellulaire57 . Le cancer se caractérise par l’envahissement de l’organisme par des cellules qui échappent aux mécanismes d’homéostasie tissulaire (processus qui maintient certaines constantes du milieu intérieur de l’organisme pour en assurer le bon fonctionnement) et ayant une capacité à se répliquer de façon illimitée notamment à cause de mutations de gènes codant différents checkpoints du cycle cellulaire.
Caractéristiques d’une cellule tumorale
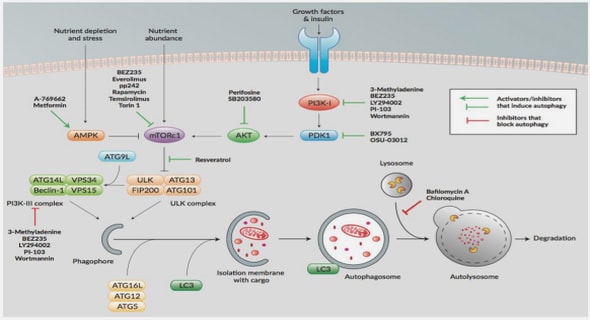
Une cellule cancéreuse se développe à partir d’une cellule normale qui va être altérée par des mutations qui ne seront pas réparées par les processus habituels. Plusieurs étapes Contexte de l’étude dans le développement du cancer ont été identifiées : l’initiation, la promotion, la progression et l’apparition de métastase61 . Tout d’abord, une lésion majeure (due à des agents environnementaux) se produit au niveau de l’ADN d’une cellule. Cette cellule transformée présente une dérégulation de la prolifération qui augmente et une diminution de l’apoptose. La cellule se multiplie donc de façon anarchique et perd son caractère différencié. Enfin, la tumeur s’étend via le réseau sanguin et lymphatique vers d’autres endroits du corps pour former des métastases. La Figure 2-2 résume les principales étapes moléculaires de la cancérogénèse (d’après le Collège Français des Pathologistes CoPath). Figure 2-2 Bases moléculaires de la cancérogénèse (d’après le Collège Français des Pathologistes CoPath). Contexte de l’étude . Cette transformation de la cellule normale en cellule cancéreuse est un processus long, qui peut durer des dizaines d’années. Au terme de cette transformation, la cellule cancéreuse a acquis un certain nombre de caractéristiques qui ont été mises en évidence par Hanahan et Weinberg en 200062 puis précisées par les mêmes auteurs en 201163 . La Figure 2-3 présente les six principales altérations de la cellule cancéreuse : l’autosuffisance en facteurs de croissance, la résistance aux signaux antiprolifératifs, la réplication cellulaire illimitée, la résistance aux signaux de mort, l’induction de l’angiogenèse et activation de l’invasion et métastase62. Auxquelles ont été ajoutées deux caractéristiques supplémentaires : la reprogrammation du métabolisme énergétique et l’échappement au système immunitaire . Figure 2-3 Mécanismes d’altération conduisant à la cancérisation cellulaire (d’après Hanahan et Weinberg, modifiée). Autosuffisance en facteurs de croissance Les cellules saines sont en général dans un état de quiescence (phase G0 du cycle cellulaire), qui peut durer plusieurs années, en attendant un signal pour rentrer dans le cycle cellulaire en phase G1. Ce passage, de l’état de quiescence au cycle de prolifération est géré par des facteurs de croissance (signaux de croissance, éléments nutritifs, etc.). Les cellules cancéreuses ont la particularité de générer elles-mêmes les facteurs de croissance nécessaires pour rentrer dans le cycle cellulaire. Contexte de l’étude – Chapitre 2 – Le plasma en oncologie 51 Résistance aux signaux antiprolifératifs Afin de gérer le nombre de cellule dans l’organisme (et de garder la meilleur homéostasie possible), celui-ci est régulé par un processus de mise en place de signaux antiprolifératifs. Ces signaux antiprolifératifs sont nécessaires afin de limiter le développement de cellules portant un ADN endommagé et présentant un potentiel oncogénique. Ils sont régulés par des gènes suppresseurs de tumeurs comme le p53, découvert en 1979 et vastement étudié à l’heure actuelle64–69. Ce dernier est une des molécules majeures qui intervient dans la protection contre la croissance de tumeurs. La perte de ce « gardien du génome » est une phase importante du processus de formation du cancer64,65 . Réplication cellulaire illimitée Plusieurs études ont mis en évidence que les télomères protégeant les extrémités des chromosomes jouent un rôle dans la capacité à proliférer de façon illimitée 70,71. En effet, les télomères sont des petites structures répétitives aux extrémités des chromosomes et qui sont raccourcies à chaque division cellulaire participant ainsi au vieillissement de la cellule. La limite de Hayflick72 ou plateau de sénescence réplicative correspond au nombre maximal de divisions cellulaires que peut subir une cellule. Chez les cellules cancéreuses, cette limite n’est pas observée, car une enzyme nommée télomérase est capable d’ajouter des fragments de télomère lors des divisions cellulaires 74. C’est ainsi que la cellule cancéreuse présente un pouvoir de prolifération quasi illimité. Résistance aux signaux de mort Afin de gérer l’homéostasie cellulaire et l’élimination de cellules potentiellement dangereuses, l’organisme à recours à trois principaux types de mort cellulaire: l’apoptose, l’autophagie et la nécrose (Figure 1-4) .
Résumé |