Etude des effets tératogènes du diabète expérimental chez le rat Wistar
Diabète et grossesse
La définition actuelle du diabète gestationnel est celle proposée lors de la IVe conférence internationale du diabète gestationnel (Metzger et Coustan, 1998) et par l’OMS. Il s’agit d’un trouble de la tolérance glucidique conduisant à une hyperglycémie de sévérité variable, débutant ou diagnostiqué pour la première fois pendant la grossesse, quel que soit le traitement nécessaire et l’évolution dans le post-partum. Cette définition regroupe ainsi essentiellement deux catégories de patientes qui sont liées à des pronostics maternels et fœtaux différents: On distingue les femmes ayant une mauvaise tolérance glucidique apparue au cours de la grossesse, le plus souvent en seconde partie de grossesse et disparaissant, temporairement au moins, en post-partum. C’est la situation la plus fréquente. Et les patientes ayant un trouble de la glycorégulation « Un diabète patent préexistant » antérieur à la grossesse et découvert à l’occasion de celle-ci. Le plus souvent, il s’agit d’un diabète de type 2 mais parfois également d’un diabète de type 1. Ce diabète est alors révélé par les modifications métaboliques induites par la gestation. Ce diabète persistera après l’accouchement (Froger et al., 2012).
Physiopathologie du diabète gestationnel
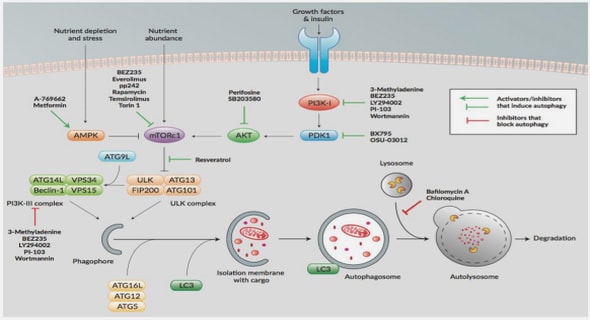
La grossesse se présente comme une situation d’accélération métabolique avec une première phase anabolique, puis une deuxième phase catabolique, cette série d’adaptations métaboliques suite à des modifications hormonales, dont la finalité est d’assurer le flux énergétique nécessaire à la croissance du fœtus. Au cours de la grossesse normale, il existe une insulinorésistance physiologique, progressive et réversible associée à un hyperinsulinisme réactionnel. Au cours du diabète gestationnel, on a cette même situation d’insulinorésistance. Par contre, l’élément prédominant est une diminution de l’insulinosécrétion avec, comme finalité, une anomalie de la tolérance glucidique. Les mécanismes précis expliquant ces anomalies physiologiques au cours de la grossesse normale et pathologique au cours du diabète gestationnel sont vraisemblablement multifactoriels(Figure3). A long terme, bien que la tolérance glucidique se normalise le plus souvent rapidement après l’accouchement, la femme ayant un antécédent de diabète gestationnel est à très haut risque de développer un diabète sucré, essentiellement de type 2. Or, sur le plan physiopathologique, il apparaît cependant que les mêmes mécanismes seraient impliqués à la fois dans le diabète gestationnel et dans le diabète de type 2, faisant penser qu’il pourrait s’agir de la même entité pathologique à des stades différents (Vambergue et al., 2002).
Anomalies fonctionnelles de l’insulinosécrétion(hyperinsulinisme)
Au premier trimestre de grossesse, sous l’effet de l’imprégnation hormonale (hormones lactogènes, progestérone, oestrogènes), l’insulinosécrétion augmente. Il en résulte une légère augmentation de la réponse insulinique au glucose sans qu’il n’y ait de majoration importante de l’insulinorésistance et donc une diminution modérée de la glycémie maternelle (Catalano et al., 1991). La première anomalie fonctionnelle rencontrée est l’augmentation de l’insulinémie à jeun. En effet, l’insulinémie à jeun augmente de manière progressive au cours de la gestation. En général, les taux sont multipliéspar deux entre le premier et le dernier trimestrede la grossesse (Vambergue et al.,2002). Cette hyperinsulinémie est secondaire à une augmentation de la production d’insuline et à une diminution de sa dégradation hépatique. En effet, il semble que la synthèse de pro-insuline (précurseur de l’insuline) soit augmentée au cours de la grossesse chez les femmes normales et chez les patientes diabétiques (Beardsall et al.,2008). Pour s’adapter à l’augmentation de l’insulinosécrétion à la fois au cours du diabète gestationnel, mais aussi au cours de la grossesse normale, les îlots de Langerhans subissent des modifications structurales et fonctionnelles. Ainsi ont été décrites une hypertrophie et une hyperplasie des cellules bêta. Par ailleurs, une mutation du gène de la glucokinase, enzyme exprimée dans les cellules β et dans les hépatocytes, impliquée dans les mécanismes d’insulinosécrétion, est retrouvée, dans certaines études, chez les femmes présentant un diabète gestationnel. Cette association est toutefois inconstante (Vambergue et al., 2002). Enfin, Au cours du diabète gestationnel, l’insulinosécrétion en réponse à une charge en glucose est altéré, elle est moins stimulée et le pic d’insulinosécrétion est retardé et altéré. b). Les modifications de la sensibilité à l’insuline (L’insulinorésistance) L’insulinorésistance hépatique, adipocytaire et musculaire est un phénomène physiologique au cours de la grossesse qui permet l’épargne du glucose disponible par le fœtus. Ce glucose est essentiel pour le fœtus car il assure 80% du métabolisme oxydatif de ses tissus. En fin de grossesse, l’insulinosensibilité diminue de 50 à 60% chez les femmes normotolérantes et atteintes de diabète gestationnel comparée à des femmes non enceintes. Cette diminution de l’insulinosensibilité est cependant passagère et s’améliore en post-partum. Les mécanismes de l’insulinorésistance au cours de la grossesse sont encore à l’heure actuelle mal définis, plusieurs causes sont cependant évoquées. Modifications de la liaison de l’insuline à son récepteur : Les études concernant l’implication de la liaison de l’insuline à son récepteur dans les mécanismes d’insulinorésistance pendant la grossesse sont contradictoires. Certaines d’entre elles ont montré que cette liaison était diminuée, d’autres qu’elle était inchangée ou augmentée (Shao etal., 2000 ; Vambergue et al., 2002). Cette liaison est soumise aux variations hormonales au niveau de l’adipocyte notamment : l’oestradiol accroit cette liaison, la progestérone pourrait l’augmenter ou la diminuer et la prolactine la diminue (Friedman et al., 1999 ; Vambergue et al., 2002). Toutefois, les troubles de l’affinité de l’insuline pour son récepteur ne semblent pas permettre d’expliquer les mécanismes de l’insulinorésistance. Anomalies de la cascade de signalisation intracellulaire : Cette insulinorésistance semble être liée à des défauts de la cascade de signalisation insulinique intracellulaire présents au cours de la grossesse normale et elle est augmentée en cas de diabète gestationnel. Il a été observé une diminution de l’activité tyrosine kinase du récepteur de l’insuline dans les cellules musculaires humaines de femmes enceintes obèses ou présentant un diabète gestationnel entraînant une captation musculaire de glucose diminuée dans le diabète gestationnel (Pratipanawatr et al., 2001), Anomalies de l’action périphérique de l’insuline:Au cours de la grossesse normale, on constate une diminution de la glycolyse par diminution de l’activité de la phosphofructokinase et de la pyruvate kinase dans le muscle squelettique. L’activité de la glucose-6-phosphate déshydrogénase est plus élevée dans le muscle de femmes enceintes comparé à celui de femmes non enceintes, suggérant une augmentation de la synthèse locale d’acide gras inhibant la glycolyse (Vambergue et al., 2002).Une possible anomalie au niveau du transport du glucose a été évoquée. Une diminution significative de la concentration du transporteur de glucose insulino-dépendant GLUT4, a été mise en évidence dans l’étude d’Okuna et al. (1995), dans le tissu adipeux des femmes enceintes comparativement à des femmes non-enceintes. c). Facteurs modulant la sécrétion insulinique et favorisant l’insulinorésistance Implications hormonales : La production hormonale au cours de la grossesse débute dès l’implantation du trophoblaste et augmente tout au long de la grossesse. Elle modifie le métabolisme des nutriments pour assurer un apport énergétique fœtal suffisant tout en maintenant l’homéostasie glucidique de la mère. Les hormones favorisent le stockage des graisses, diminuent les dépenses énergétiques et abaissent la clairance du glucose (Shaoetal.,2000). Les hormones lactogènes (prolactine, hormone lactogène placentaire et hormone chorionique somatotrope) sont considérées comme des facteurs dominants dans la mise en place de l’insulinorésistance maternelle (Newbern et Freemark, 2011). Des essais cliniques ont montré que des taux sériques de prolactine élevés ou des infusions d’hormone lactogène placentaire chez l’humain conduisent à un état de résistance à l’insuline et à une hyperinsulinémie(Friedman et al., 1999). Les œstrogènes sont également augmentés chez la femme enceinte. Ils proviennent à la fois de la sécrétion placentaire et de l’aromatisation des androgènes du fœtus. Ils s’élèvent à partir du 35e jour de gestation. La nature de l’implication des œstrogènes est discutée. Les effets seraient toutefois minimes. La progestérone dont la concentration s’élève au soixante-cinquième jour de la grossesse a un effet direct sur le métabolisme glucidique. Elle est à l’origine d’une diminution de la tolérance au glucose en réduisant la capacité de l’insuline à inhiber la production hépatique de glucose et le transport du glucose (Nelson et al.,1994). Le cortisol est sûrement l’hormone la plus diabétogène. Sa sécrétion est stimulée par une augmentation de la production hépatique de la globuline (CBG). En fin de grossesse, la cortisolémie est deux fois et demiplus élevée. Cette hormone est responsable d’une augmentation de la production hépatique de glucose et d’une diminution de l’insulinosensibilité (Handwerger et Freemark, 2000). Le mécanisme responsable serait une diminution de la phosphorylation sur les résidus tyrosine du récepteur de l’insuline associée à une diminution du contenu en InsulinReceptorSubstrate 1 (IRS1) de la cellule musculaire (Barbour et al.,2002). Les cytokines : Plus récemment, le rôle du TNF-α (TumorNecrosis Factor), dans l’instauration de l’insulinorésistance a été évoqué. La sécrétion de cette cytokine proinflammatoire pendant la grossesse provient des adipocytes et plus majoritairement du placenta. L’augmentation des niveaux circulants de TNF-α chez les femmes enceintes pourrait être un facteur déterminant dans la mise en place de la résistance à l’insuline notamment par son effet répresseur sur la sécrétion et l’expression de l’adiponectine. Kirwanet al.(2002) ont montré qu’il existait, au troisième trimestre de grossesse, une corrélation négative entre les taux circulants de TNF-α et la sensibilité à l’insuline. Il participerait également à l’altération de la voie de signalisation insulinique intracellulaire dans les tissus cibles périphériques par le biais d’une diminution de la phosphorylation des molécules IRS. Enfin, il exerce un rôle inhibiteur de translocation de la protéine de transport du glucose GLUT4 (Bouglé et Annane, 2009).
Facteurs tératogène
Plusieurs études expérimentales ont essayé de disséquer les facteurs tératogènes dans le diabète maternel. (Styrud et Eriksson,1992 ; Buchananet al.,1994 ; Viana et al.1996; Eriksson et Wentzel 2015). a. Glucose: L’augmentation detaux du glucose est la caractéristique de l’état diabétique.Il existe de nombreuses preuves cliniques que les taux accrus du glucose / HbA1c sont corrélés avec un risque élevé de malformation congénitale chez la progéniture (Hanson et al.,1990 ; Zhao et Reece, 2013).Des études expérimentales, montrent une corrélation entre l’augmentation des taux sériques du glucose et le risque de malformations fœtales chez les rats diabétiques (Eriksson et Wentzel 2015). De plus, l’injection du glucose à des rattes gestantes non diabétiques ont également eu des effets tératologiques. Fine et al.,(1999) ont montré que l‘augmentation de la concentration du glucose in vitro dans la culture des embryons, provoque des perturbations du développement et peut provoquer des anomalies du tube neural (NTD) chez les embryons de souris. L’augmentation du glucose produirait un flux glycolytique élevé, ainsi qu’une activité mitochondriale du cycle de l’acide citrique et une phosphorylation oxydative élevée. Plusieurs conséquences de l’augmentation de métabolisme du glucose ont été suggérées, avec une augmentation de la production mitochondriale de superoxyde peut posséder le potentiel tératogène le plus prononcé. Cependant, l’activité de l’hexose monophosphate, la formation des espaces réactives de l’oxygène (ROS), l’inhibition de la glycéraldéhyde-3-phosphate déshydrogénase (GAPDH) et la formation élevée d’alpha-oxoaldéhyde peuvent jouer un rôle dans la dysmorphogénèse embryonnaire induite par le diabète (Eriksson et Wentzel 2015).
Accumulation du sorbitol
Plusieurs complications causées par le diabète ont été attribuées à l’accumulation de sorbitol, la notion que ce mécanisme pourrait être impliqué dans l’embryopathie diabétique a donc été étudiée(Lee et al., 1995). Dans un état diabétique, une forte proportion du glucose est métabolisée par la «voie de polyol», où l’aldose réductase réduit le glucose en sorbitol. Le sorbitol peut s’accumuler dans les tissus et causer des dommages par des effets osmotiques (Siman, 1997). L’augmentation de la concentration du glucose dans le diabétique gestationnel expérimental est en effet mise en parallèle avec une augmentation de la concentration en sorbitol embryonnaire (Akazawa, 2005). De plus, le diabète maternel a provoqué une augmentation à la fois de la teneur en sorbitol et de l’activité de l’aldose-réductase dans les fœtales. Cependant, même si l’on a montré que les inhibiteurs de l’aldose réductase réduisent l’accumulation embryonnaire de sorbitol, ils échouent in vivo et in vitro pour inhiber la tératogénicité du diabète (Siman, 1997 ; Eriksson, 2009). c. Carence en acide arachidonique : Une carence en acide arachidonique et des sons dérivés métabolique a été proposée pour induire des malformations au cours de diabète gestationnelle, la supplémentassions en acide arachidonique à la fois in vivo et in vitro protège contre le diabète et les défauts de fusion du tube neural induits par la concentration élevée en glucose(Goldman et al, 1985 ; Eriksson, 2009 ; Eriksson et Wentzel,2012). Les études de Wentzel et al,(1999) ont montré que la concentration de prostaglandine E2 (PGE2) diminuée au jour 10, mais pas au jour 11, chez les embryons des rats diabétique. La PGE2 est formée à partir de l’acide arachidonique à travers la voie cyclooxygénase. On a signalé que les inhibiteurs de la cyclooxygénase étaient à la fois tératogènes (Wentzel et Eriksson, 1998 ; Eriksson et al., 2003 ; Higa et al., 2007) et protégés contre les anomalies du tube neural induites par l’hyperglycémie (Kubow et al, 1993). I.1.4. 3. Malformations embryonnaires associées avec le diabète maternel : Elles sont dues aux effets tératogènes des désordres métaboliques et de l’hyperglycémie maternels, et se développent dans les sept premières semaines de grossesse, atteignant le système cardio-vasculaire, uro-génital, le squelette, le système nerveux central (SNC). On constate un risque 7 à 10 fois plus élevé chez les enfants de mères diabétiques avant la grossesse. Elles sont souvent à l’origine de fausses couches. Mais en ce qui concerne les patientes souffrant de diabète gestationnel, il s’agit le plus souvent d’une hyperglycémie développée au 2ème trimestre de la grossesse. L’organogenèse étant déjà effectuée, il existe donc un risque de malformation fœtale sensiblement égal à celui de la population générale (il ne faut pas oublier les patientes dont le diabète, antérieur à la grossesse mais méconnu, a été diagnostiqué pendant la grossesse) (Zhao et Reece, 2013). a). Système nerveux central « Tube neural » : Les malformations du SNC les plus fréquemment associées au diabète sont celles qui intéressent les premières étapes de la neurulation, avant la fin de la 4e semaine du développement : le déterminisme de la « bilatéralisation » de l’encéphale (et de la face) dont la perturbation conduit à l’holoprosencéphalie, et la fermeture du tube neural. Les modèles expérimentaux animaux confirment d’ailleurs que le diabète maternel ou l’hyperglycémie modifient l’expression de gènes particulièrement impliqués dans ces phénomènes (Fine et al., 1999 ; Liao et al., 2004). L’holoprosencéphalie et les anomalies faciales qui s’y associent sont observées dans 1 à 3 % des grossesses de femmes diabétiques (à comparer à une fréquence globale estimée à 1/250). Les neurodysraphies les plus évocatrices du diabète sont les lésions étendues, rachischisis voire craniorachischisis, particulièrement si elles sont associées à des dysosotoses rachidiennes, et les encéphalocèles.
Système cardiovasculaire « défaut congénital au niveau du cœur
Les cardiopathies (hors cardiomyopathies), dont la fréquence est globalement multipliée par 5 dans un contexte diabétique, sont aussi des malformations à déterminisme « précoce » puisque la morphogenèse cardiaque est achevée à 50 jours de développement. Les communications intraventriculaires (CIV) sont les plus fréquemment observées, mais, paradoxalement, relativement moins souvent que dans la population générale Plus caractéristiques du diabète sont les ventricules droits à double issue (VDDI) (Wren et al., 2003), les transpositions des gros vaisseaux et les troncs artériels communs, ainsi que les atrésies tricuspides, les hétérotaxies, ou les syndromes d’hypoplasie du cœur gauche (Wren et al., 2003 ; Frias et al., 2007). La relative fréquence des cardiopathies conotruncales chez les enfants de mères diabétiques a suggéré l’implication des crêtes neurales céphaliques qui peuplent le pôle artériel du tube cardiaque primitif et participent à la formation des gros vaisseaux et d’une partie du septum interventriculaire : hypothèse confirmée par l’étude de modèles animaux, in vivo ou in vitro, montrant un défaut de migration, de différenciation et de prolifération des cellules neurocrestales cardiaques, dans un contexte de diabète maternel ou d’hyperglycémie (Kumar et al., 2007). Via des modèles analogues, l’hypoglycémie peut aussi s’avérer responsable d’anomalies de la morphologie et de la fonction cardiaques fœtales (Smoaket al, 2002). c). Système musculosquelettique : Les atteintes squelettiques les plus fréquentes dans le diabète sont les anomalies rachidiennes, à type de dysostoses, traduisant une anomalie de la mise en place des somites (autour de la 4e semaine du développement) (Frias etal, 2007). Elles sont isolées ou bien associées à des dysraphies ou dysgénésies du pôle caudal Au niveau des membres, dont l’architecture se met on observe essentiellement des anomalies réductionnelles : Les plus caractéristiques sont les atteintes radiales ou fémorales, généralement D B unilatérales,hypoplasie ou bifidité et les polydactylies ou duplications, en particulier des hallux(Åberg et al, 2001 ; Frias et al, 2007). d). Effet de diabète sur la pré-implantation et sur le placenta : Dès que barrière placentaire se met en place, lors de la formation des premières villosités (à J21 après la conception), le transfert de glucose de la mère à l’embryon puis au fœtus s’organise. Il s’effectue au travers de la barrière, par un système de transfert facilité par le transporteur GLUT1, qui assure, en permanence, un parallélisme entre la glycémie maternelle et la glycémie fœtale : l’hyperglycémie, comme l’hypoglycémie maternelle sont transmises directement au fœtus. Celui-ci est capable, dès le second trimestre, de réagir aux variations de sa glycémie par ses mécanismes régulateurs pancréatiques et développe une hyperplasie de ses îlots de Langerhans en réponse à l’hyperglycémie de sa mère diabétique. L’examen du placenta est d’un apport majeur au diagnostic de diabète maternel, même en dehors de toute morbidité fœtale (Benirschke et al, 1999 ; Evers et al, 2003).Classiquement, le placenta est volumineux pour l’âge gestationnel, surtout pour les enfants non macrosomes (Evers et al, 2003); il semblerait l’être moins qu’attendu pour le poids fœtal (rapport P/F plus faible que la normale) (Roche et al, 2004).Il est épais, à la coupe, d’aspect macroscopique hydropique, avec un cordon ombilical « gras », de diamètre élevé, qui présente une artère unique plus souvent que dans la population normale. Il faut remarquer que l’examen du placenta à lui seul est capable d’orienter vers un état de dysrégulation maternelle glycémique, probablement de l’ordre d’une augmentation de la résistance à l’insuline, en deçà des seuils détectables par les examens biologiques de dépistage du diabète, constatent que leur groupe de placentas « contrôles » d’enfants de poids anormalement élevé issus de mères non diabétiques a un aspect plus proche de ceux des enfants de mères diabétiques que de ceux des enfants contrôles de poids normal. Ils relèvent que ces enfants ont des mères dont l’indice de masse corporelle (IMC) est élevé et donc soulignent une possible résistance à l’insuline infraclinique. Ces observations rejoignent celles des fœtopathologistes confrontés au quotidien au problème des décès inopinés in utero de fœtus en fin de grossesse, en dehors de toute pathologie connue (Delezoide et al., 2008).
Chapitre 1 : Synthés bibliographique |