ETUDE DE LA DISSOLUTION COMPARATIVE
IN VITRO DU METRONIDAZOLE 250 mg
GENERALITES SUR LE TEST DE DISSOLUTION IN VITRO DES MEDICAMENTS
L’essai de dissolution in vitro est un test pharmaco-technique destiné à déterminer la plus ou moins grande aptitude des formes galéniques à laisser passer en solution, dans un milieu déterminé, le ou les principes actifs qu’elles contiennent. Le passage en solution est apprécié par le dosage du principe actif libéré dans des échantillons prélevés du milieu de dissolution à intervalles de temps différents [11]. Les formes pharmaceutiques concernées par les essais de dissolution sont les formes orales solides (libération immédiate ou modifiée), les dispositifs 9 transdermiques, les microparticules injectables, les capsules molles, suppositoires et ovules [9].
INTERET DU TEST DE DISSOLUTION
L’essai de dissolution peut intervenir à plusieurs stades de l’élaboration du médicament. Il permet : – de connaître la cinétique de dissolution d’un principe actif ; – d’établir des profils de dissolution comme guide de la formulation des formes orales solides et pour la mise en évidence du degré de pertinence de l’essai de dissolution ; – de démontrer la reproductibilité du procédé de fabrication et la conformité du produit fini avec les lots précédents.
FACTEURS INFLUENCANT LE TEST DE DISSOLUTION
FACTEURS DEPENDANTS DU MEDICAMENT
Les facteurs suivants peuvent influencer le test de dissolution : Les propriétés physico-chimiques du principe actif : solubilité, granulométrie, polymorphisme ;Les excipients : liants, délitants, lubrifiants, tensioactifs, diluants ;La forme pharmaceutique : nature de la forme galénique, procédé de fabrication, conditions de conservation, interactions principe actif/excipients
FACTEURS DEPENDANTS DE LA METHODE DE DISSOLUTION
Les facteurs décrits ci-dessous peuvent influencer le test de dissolution : Les conditions opératoires : agitation, méthode de prélèvement, filtration, vibrations ; 10 Les paramètres de dissolution : nature, pH et volume du milieu de dissolution, vitesse d’agitation, temps de prélèvement température, gaz dissous
GENERALITES SUR LE METRONIDAZOLE
Le métronidazole est un médicament utilisé pour traiter les infections causées par des parasites (amibes) et des bactéries anaérobies. Il peut également être administré pour traiter la diarrhée due à Entamoeba histolytica, Giardia lamblia ou Clostridium, ainsi que les infections vaginales ou divers types d’infections bactériennes. Il est disponible sous forme de comprimés à 250 mg et de capsules à 500 mg, de crèmes et suppositoires vaginaux et d’une crème pouvant être appliquée sur la peau. La dose recommandée de métronidazole variera en fonction du type d’infection traitée [31]. La figure 3 présente la structure chimique du métronidazole. Figure 3 : structure chimique du métronidazole
PROPRIETES PHARMACODYNAMIQUES
Le spectre d’activité antimicrobienne : les concentrations critiques séparent les souches sensibles des souches de sensibilité intermédiaire et ces dernières, des résistantes : S < = 4 mg/L et R > 4 mg/L. 11 La prévalence de la résistance acquise peut varier en fonction de la géographie et du temps pour certaines espèces. Il est donc utile de disposer d’informations sur la prévalence de la résistance locale, surtout pour le traitement d’infections sévères. Ces données ne peuvent apporter qu’une orientation sur les probabilités de la sensibilité d’une souche bactérienne à cet antibiotique.
PROPRIETES PHARMACOCINETIQUES
Absorption : Après administration orale, le métronidazole est rapidement absorbé, 80 pour cent au moins en une heure. Les pics sériques obtenus après administration orale sont similaires à ceux obtenus après administration intraveineuse de doses équivalentes. La biodisponibilité par voie orale est de 100 pour cent. Elle n’est pas significativement modifiée par l’ingestion simultanée de nourriture. Distribution : – Environ 1 heure après la prise unique de 250 mg, la concentration sérique maximale atteinte est, en moyenne, de 10 microgrammes/ml. Après 3 heures, la concentration sérique moyenne est de 13,5 microgrammes/ml. – La demi-vie plasmatique est de 8 à 10 heures. – La liaison aux protéines sanguines est faible : inférieure à 20 pour cent. – Le volume apparent de distribution est important aux environs de 40 L (soit 0,65 L/kg). – La diffusion est rapide et importante, avec des concentrations proches des taux sériques, dans : les poumons, les reins, le foie, la peau, la bile, le liquide céphalo rachidien, la salive, le liquide séminal, les sécrétions vaginales. Le métronidazole traverse la barrière placentaire et passe dans le lait maternel. Biotransformation : Le métabolisme est essentiellement hépatique. Par oxydation, deux composés principaux sont formés : 12 – le métabolite « alcool », métabolite principal, ayant une activité bactéricide sur les bactéries anaérobies d’environ 30 pour cent de celle du métronidazole, et une demi-vie d’élimination d’environ 11 heures ; – le métabolite « acide », en faible quantité, ayant une activité bactéricide d’environ 5 pour cent de celle du métronidazole. Excrétion : Forte concentration hépatique et biliaire. Faible concentration colique. Faible élimination fécale. Excrétion surtout urinaire puisque le métronidazole et les métabolites oxydés, excrétés dans les urines représentent environ 35 à 65 pour cent de la dose administrée.
OBJECTIF GENERAL
L’objectif de ce travail était de fournir, à l’échelle internationale, un processus de contrôle et une garantie de la qualité des médicaments génériques à base de métronidazole produits à Winthrop Pharma Sénégal. 2. OBJECTIFS SPECIFIQUES Cette étude consistait spécifiquement à : – Déterminer les profils de dissolution des comprimés du métronidazole princeps et du Flagyl® générique ; – Calculer le facteur de similarité f2 permettant de comparer les profils de dissolution.
PRESENTATION DE WINTHROP PHARMA SENEGAL
Le groupe Sanofi occupe la première place en Europe et la troisième mondiale de l’industrie pharmaceutique avec une part de marché égale à 5%. Situé sur la route de Rufisque, Winthrop Pharma Sénégal (WPS), filiale du groupe Sanofi, est la première industrie pharmaceutique du Sénégal. WPS est une industrie du secteur secondaire chargée de produire et de distribuer des produits pharmaceutiques génériques plus accessibles aux populations locales (20 à 30% moins chers par rapport aux médicaments princeps), tout en respectant les normes de bonnes pratiques
HISTORIQUE
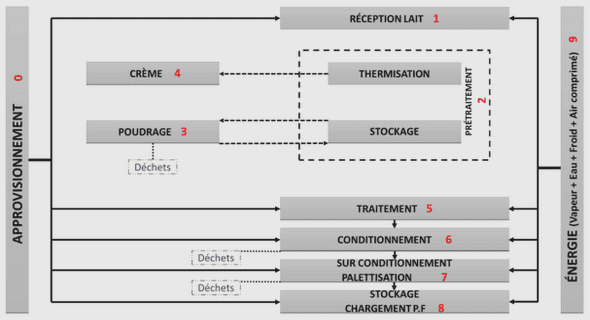
La Société Industrielle Pharmaceutique Ouest-Africaine (SIPOA), créée en 1973, était une société d’économie mixte née d’une convention signée en Septembre 1972 entre l’état sénégalais et Bohringer Ingelheim, compagnie pharmaceutique allemande. La production de la SIPOA était constituée de médicaments génériques essentiellement destinés à l’approvisionnement des structures publiques de santé. En 1989, la SIPOA avait été rachetée par le groupe Rhône Poulenc Rorer qui a opéré de gros investissements de rénovation de l’outil avec la délocalisation de bon nombre de ses spécialités. En 2000, la SIPOA est devenue Aventis Pharma, fruit de la fusion mondiale entre Rhône Poulenc et Hoechst. En 2004, la société est devenue Sanofi Aventis, fruit de la fusion entre Aventis Pharma et Sanofi Synthélabo. Pour répondre à sa vocation africaine et marquer son identité, la société a été baptisée Africasoins Production Groupe Sanofi Aventis, en 2006. En 2008, le groupe prend le nom de WPS, filiale du groupe Sanofi. En 2011, Sanofi-Aventis simplifie son nom en Sanofi. 3. ACTIVITES WPS fabrique, conditionne, contrôle, libère, stocke, distribue et exporte des médicaments à usage humain. Ces médicaments regroupent des formes solides (comprimés nus et pelliculés), des formes liquides (sirops et suspensions en flacons) et des formes liquides stériles à petit volume de solution et à stérilisation terminale (ampoules injectables). Les produits sont destinés aussi bien au marché local qu’à l’export
PRESENTATION DU LABORATOIRE DE CONTROLE DE WPS
WPS a beaucoup investi dans sa politique de qualité qui s’applique aussi bien à la fabrication qu’au service clientèle. Le laboratoire de contrôle de WPS est composé d’ingénieurs et de techniciens qui assurent le contrôle de la qualité des médicaments destinés au public. Il est équipé d’appareils et d’instruments de mesure permettant de tester différents critères conformément aux recommandations de qualité du groupe et des instances pharmaceutiques mondiales. La partie physico-chimie et pharmacotechnie possède, entre autres, trois chaînes de chromatographie liquide haute performance, un spectrophotomètre ultraviolet (UV), un spectrophotomètre infrarouge, deux appareils pour les tests de dissolution et un délitométre. La partie microbiologie comprend une salle de contrôle de stérilité et des appareils tels qu’un incubateur et un compteur de particules.
INTOODUCTION |