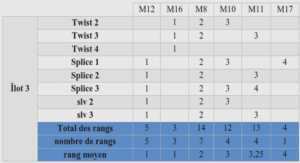
Détection, identification et quantification des microorganismes filamenteux
La prolifération excessive de microorganismes au sein des boues activées reflète un problème de fonctionnement de la station d’épuration. Une identification précise des bactéries incriminées peut permettre de fournir aux exploitants des pistes quant à la nature du dysfonctionnement. Afin de trouver les moyens d’action les plus appropriés contre un épisode de foisonnement filamenteux ou de moussage, il est au préalable indispensable d’identifier de façon précise les bactéries à l’origine de ce dysfonctionnement. Ainsi Eikelboom (1975) a fournit une méthode d’identification des différents microorganismes filamenteux. Ces derniers y sont classés en fonction des critères morphologiques suivants : Des fiches permettant l’identification ont été définies (Jenkins et al., 1984). Elles proposent plusieurs démarches à suivre afin d’identifier avec le plus de précision et de certitude possible les filaments observés en se basant sur différents critères (taille des cellules, colorations cytoplasmiques, autres critères morphologiques). La caractérisation morphologique présente ainsi de nombreuses limites. En effet, les colorations, et en particulier la coloration de Gram, donne des réponses variables pour certains filaments en fonction de leur état physiologique (Jenkins et al., 2003). Dans certains cas, des variations de la composition des eaux usées peuvent entraîner un changement dans la morphologie des filaments. Il faut également noter que certaines espèces ayant d’ordinaire une gaine entourant leur filament peuvent ne plus en avoir. En effet, les gènes permettant à la bactérie de la synthétiser sont parfois portés par des plasmides. Et en cas de perte de ces derniers, la bactérie perd sa faculté à synthétiser une gaine (Wagner, 1994). Certaines espèces ont des caractéristiques morphologiques très proches et sont donc très difficiles à différencier (Wagner, 1994; Jenkins et al., 2003). Certaines espèces peuvent exister sous forme de bactéries dispersées en plus de la forme filamenteuse. C’est le cas pour Sphaerotilus natans (Gaval, 2001), Microthrix parvicella (Richard et al., 1985) et Thiothrix nivea (Ramothokang et al., 2006b) notamment.
Méthodes d’identification moléculaires
Face aux difficultés et aux erreurs pouvant être induites par la méthode d’identification classique, les chercheurs ont développé à partir des années 90 des méthodes d’identification basées sur la biologie moléculaire. Ces techniques s’appuient sur l’analyse de l’ADN et/ou de l’ARN des bactéries. La cible qui a été choisie afin de caractériser au mieux la complexité de la communauté bactérienne, est l’ARNr 16S. Cette molécule possède le double avantage d’être très abondante et conservée. Mais elle possède également dans sa séquence des régions variables, caractéristiques de chaque espèce ou genre bactérien. Elle permet donc de pouvoir comparer des espèces dans un même domaine, mais aussi de pouvoir différencier les différentes souches d’une même espèce. La réaction de PCR ou Polymerase Chain Reaction, est la technique qui a révolutionné la biologie moléculaire et est à l’origine de son expansion au cours de ces vingt dernières années. De nombreuses techniques d’identification moléculaire qui seront décrites par la suite sont basées sur l’utilisation de cette réaction. Le principe de la réaction de PCR sera décrit en détail dans le chapitre suivant, on peut cependant dire qu’elle est basée sur l’amplification in vitro d’une portion d’ADN donnée à l’aide d’une enzyme, l’ADN polymérase (Mullis & Faloona, 1986). Dans le cas de microorganismes connus, l’amplification d’une séquence de l’ADNr 16S spécifique de l’espèce bactérienne cible peut mettre en évidence sa présence dans un échantillon donnée. La QPCR ou PCR quantitative en temps réel ajoute un aspect quantitatif à l’identification. En effet, à la différence de la PCR classique, cette technique permet d’estimer la quantité d’ADN contenue dans l’échantillon à analyser. Cette technique sera également décrite en détail dans le chapitre Matériels et Méthodes.
Cette méthode implique une extraction d’ADN à partir de boues, suivie d’une amplification à l’aide d’amorces universelles puis d’un clonage des gènes codant pour l’ARNr 16S des différentes souches bactériennes, la création de banques d’ARNr 16S, et enfin un séquençage des produits de clonage. L’identification des microorganismes est ensuite réalisée en comparant les séquences ainsi obtenues à des bases de données. Actuellement, environ 700 000 séquences d’ADNr 16S sont disponibles sur la base de données du NCBI (septembre 2007). Les séquences des différentes bactéries filamenteuses étant maintenant connues, elles sont facilement détectables et identifiables par cette méthode.