Des devoirs évalués par compétences.
Compétences exigibles au B.O. La matière à différentes échelles : du noyau à la galaxie. Particules élémentaires : électrons, neutrons, protons. Charge élémentaire e. Interactions fondamentales : interactions forte et faible, électromagnétique, gravitationnelle. Solide ionique ; interaction électrostatique ; loi de Coulomb. Solide moléculaire ; interaction de Van der Waals ; liaison hydrogène. Electronégativité. Effet du caractère polaire d’un solvant lors d’une dissolution. Conservation de la matière lors d’une dissolution. Variation de température et transformation physique d’un système par transfert thermique. Nomenclature des alcanes et des alcools ; formule semi-développée. Lien entre les températures de changement d’état et la structure moléculaire dans le cas de l’eau, des alcools et des alcanes. Nomenclature des alcanes et des alcools. Compétences évaluées Cette épreuve permet d’évaluer les compétences de la démarche scientifique : • Connaître (RCO) • S’approprier (APP) • Analyser (ANA) • Réaliser (REA) • Valider (VAL) • Communiquer (COM) Mise en œuvre Devoir prévu pour évaluation sommative d’une durée de 1h30. L’évaluation nécessite l’utilisation de la feuille de calcul au format tableur correspondante. Remarques La compétence communiquer (COM) est évaluée globalement sur l’ensemble du devoir avec comme critères observables : présenter les résultats de manière adaptée (chiffres significatifs …) ; rédiger les réponses en utilisant une langue correcte et un vocabulaire scientifique adapté. Cette méthode de notation a été testée avec une classe de première S. Les notations comparées des 34 copies, par points (méthode classique) puis à l’aide du tableau de compétences ont donné des moyennes comparables (le différentiel obtenu entre est de 0,5 point). Le maximum d’écart obtenu par copie est de 1 point (obtenu sur 6 copies seulement). Auteur Florence TROUILLET – Lycée Claude de France – Romorantin (41) ÉNONCÉ NOM : ……………………… Première S L’usage des calculatrices est autorisé XX/XX/201X DS de physique-chimie n°5 NOTE : RCO A B C D APP A B C D ANA A B C D REA A B C D VAL A B C D COM A B C D Vous soignerez la présentation et l’orthographe de votre copie, vous rédigerez des phrases pour répondre aux questions posées et vous veillerez à garder un nombre de chiffres significatifs cohérents. Ex n°1 : L’atome d’hélium (sur 6 pts.) L’hélium est un gaz noble de numéro atomique Z = 2. Il est, après l’hydrogène, l’élément le plus abondant de l’Univers. Il possède deux isotopes stables : 4He (le plus abondant), et 3He. La grande majorité de l’hélium a été formée par la nucléosynthèse primordiale, dans les minutes suivant le Big Bang. De l’hélium est également formé au cœur des étoiles par la fusion nucléaire de l’hydrogène ; il est ensuite utilisé par les étoiles en fin de vie comme matière première pour la création d’éléments plus lourds, par des processus bien plus rapides, voire explosifs (supernovæ). L’hélium de l’Univers ne provient donc qu’en très faible partie des étoiles ! Dans cet exercice, nous allons étudier le noyau de l’atome d’hélium 4He, constitué de 2 protons et 2 neutrons. On considèrera que ce noyau est compact, c’est-à-dire que les nucléons sont jointifs (comme sur le schéma ci-contre).
Les solvants.
Un solvant est une substance, liquide à sa température d’utilisation, qui a la propriété de dissoudre, de diluer ou d’extraire d’autres substances sans les modifier chimiquement et sans lui-même se modifier. Les solvants sont utilisés dans des secteurs très diversifiés tels que le dégraissage, la peinture, la détergence, la synthèse organique, et représentent des quantités considérables en termes de tonnage et de chiffre d’affaires. Vos documents : Doc. 1 : le tétrachlorure de carbone Le tétrachlorure de carbone est un composé chimique chloré de formule brute CCl4. À pression et température ambiante, c’est un liquide incolore, très volatil dont les vapeurs sont nocives pour les êtres vivants et dangereux pour la couche d’ozone. En chimie organique, le tétrachlorure de carbone est souvent employé en tant que solvant, même si son usage tend à diminuer en raison de sa forte toxicité. Il est ainsi souvent remplacé par le chloroforme ou le dichlorométhane. Doc. 2 : Echelle d’électronégativité de Pauling L’électronégativité d’un élément est une grandeur qui caractérise sa capacité à attirer les électrons lors de la formation d’une liaison chimique avec un autre élément. La différence d’électronégativité entre ces deux éléments détermine la nature de la liaison covalente. Le tableau ci-contre donne les valeurs de l’électronégativité établies selon les mesures de Pauling pour quelques éléments. Lorsqu’une liaison de covalence relie deux atomes dont la différence d’électronégativité est comprise entre 0,3 et 2,0 alors la liaison est polarisée ; au-delà de 2,0, la liaison est ionique. Doc. 3 : L’eau L’eau est le solvant le plus courant. Son caractère polaire en fait notamment un solvant efficace pour beaucoup de corps solides trouvés sur Terre ; l’eau est ainsi quelquefois désignée sous le nom de « solvant universel ». Doc. 4 : Deux solides, le diiode et le fluorure de calcium Questions : 1. Parmi les deux solides présentés (doc. 4), reconnaître le solide ionique et le solide moléculaire. (APP) 2. Les liaisons carbone-chlore et hydrogène-oxygène sont-elles polarisées ? (APP) 3. Justifier le caractère polaire de la molécule d’eau (on pourra s’aider d’un schéma). (ANA) 4. Le tétrachlorure de carbone ne peut pas dissoudre le fluorure de calcium solide mais il peut dissoudre des cristaux de diiode car il est apolaire. Justifier le caractère apolaire du tétrachlorure de carbone. (ANA) 5. L’eau dissout le fluorure de calcium. Ecrire l’équation de dissolution du fluorure de calcium CaF2(s) solide dans l’eau. (ANA) 6. Soit une solution de fluorure de calcium dont la concentration en ions fluorure est de 1,0.10-1 mol.L-1. Quelle est la concentration molaire en soluté apporté C de cette solution ? (ANA et REA) Ex. n°3 : L’ADN (sur 2 pts) Si l’on représente le lien entre les deux bases azotées adénine et thymine en interactions dans un brin d’ADN, on obtient : 1. Quelle liaison représentent les pointillés entre les deux bases azotées thymine et adénine ? (RCO) 2. Enoncer la propriété de l’atome d’azote qui permet la création de cette liaison ? (RCO) 3. Les brins seraient-ils aussi solidement attachés s’il s’agissait d’interactions de Van der Waals ? Justifier. (ANA) Ex. n°4 : Antisepsie (sur 7 pts) Le propan-1-ol est un alcool qui se forme en même temps que l’éthanol, en très petite quantité, lorsqu’une fermentation ne se déroule pas correctement. Le propan-1-ol est un des principes actif du Stérillium®, solution utilisée en chirurgie pour désinfecter les mains et des avant-bras (antisepsie chirurgicale). Questions de connaissances 1. Que se passe-t-il lors de la vaporisation pour un corps pur ? Cocher la bonne réponse (RCO) : Il y a rupture d’interactions moléculaires avec accroissement de l’agitation thermique des molécules ; Il y a seulement rupture des interactions moléculaires, la température restant constante. 2. Quelles sont les interactions moléculaires qui s’exercent au sein des alcools ? Cocher la bonne réponse (RCO) : les forces de Van der Waals et les liaisons hydrogène ; seulement les forces de Van der Waals ; seulement les liaison hydrogène. 3. Quelles sont les interactions moléculaires qui s’exercent au sein des alcanes. Cocher la bonne réponse (RCO) : les forces de Van der Waals et les liaisons hydrogène ; seulement les forces de Van der Waals ; seulement les liaison hydrogène. 4. Quelles sont les interactions moléculaires les plus fortes ? Cocher la réponse (RCO) : les forces de Van der Waals ; les liaison hydrogène. Autour du propan-1-ol 5. Du propane ou du propan-1-ol, lequel possède la température d’ébullition la plus basse ? Justifier votre réponse à l’aide des interactions intermoléculaires. (APP) 6. Donner la formule semi-développée du propan-1-ol et donner sa formule topologique. (REA) 7. Représenter un alcool isomère du propan-1-ol et le nommer. (REA) 8. Identifier la classe du propan-1-ol. (ANA) Température d’ébullition de divers alcools Alcool Température d’ébullition (en °C) éthanol 78 propan-1-ol 97 pentan-1-ol 137 2-méthylbutan-1-ol 130 2,2-diméthylpropan-1-ol 113 9. On a réalisé les mesures des températures d’ébullition de divers alcools. Les résultats sont regroupés dans le tableau ci-contre. a) Quel est le point commun entre le pentan-1-ol, le 2-méthylbutan-1-ol et le 2,2-diméthylpropan-1-ol ? (ANA) b) Interpréter les mesures obtenues pour les 3 alcools à chaîne linéaire. (ANA) c) Interpréter les mesures obtenues pour le pentan-1-ol, le 2-méthylbutan-1-ol et le 2,2-diméthylpropan-1-ol. (ANA) Présentation de la démarche suivie pour évaluer ce devoir Evaluation des exercices : Les compétences évaluées dans ce devoir sont celles présentées dans la grille « sujet d’écrit au baccalauréat ». Pour chaque exercice, les questions ont été regroupées par domaines de compétences et organisées de façon à évaluer globalement chaque domaine dans une progression qui suit le cheminement de la démarche scientifique. Cela facilite l’évaluation des compétences mises en œuvre et donne du sens à l’évaluation.
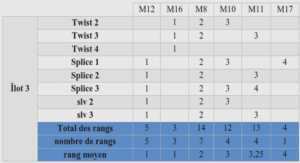
Pour évaluer chaque exercice par compétences, il faut renseigner un tableau construit sur le modèle des tableaux utilisés pour la notation des résolutions de problèmes scientifiques en Terminale S. On a construit un tableau par exercice. Chaque tableau reprend les domaines de compétences mobilisés. Pour chacun, on a détaillé les critères de réussite pour le niveau A. Ces critères correspondent aux capacités mobilisées dans les questions. Il s’agit d’une évaluation globale du domaine avec un positionnement sur 4 niveaux de compétences. Si les indicateurs apparaissent dans leur totalité, le niveau obtenu est le niveau A. S’ils apparaissent partiellement, c’est le niveau B qui est obtenu. S’ils apparaissent de manière insuffisante, le niveau obtenu est le niveau C. S’ils ne sont pas présents, c’est niveau est D. Pour chaque domaine de compétences, on choisit ensuite un poids. Ici, pour chaque exercice, on a choisi des poids dont la somme correspond au nombre de points indiqués sur l’énoncé. On est bien évidemment libre de procéder autrement. Ce tableau est un outil du professeur qui peut être communiqué aux élèves. Cela leur permettra de mesurer finement leurs acquis. On peut faire aussi le choix de ne pas le donner et de se contenter de transmettre bilan de compétences établi sur les 4 exercices qui figure dans le bandeau. Tout dépend de la stratégie poursuivie par le professeur. Transformation du bilan de compétences en note chiffrée : L’évaluation de ce devoir peut très bien s’arrêter au bilan de compétences ; cependant, si on souhaite rendre aux élèves une note sur 20, alors on procédera comme il suit. Le tableau rempli, on complète la feuille de calcul correspondante (tableur). On commence par choisir le nombre de points sur lequel on veut noter cet exercice dans la cellule I1 (ici notation sur 20 points). On choisit ensuite d’affecter les points pour les niveaux atteints en complétant les cellules K6 à K9 : par exemple, 3 points pour le niveau A, 2 points pour le niveau B, 1 point pour le niveau C et zéro pour le niveau D. On renseigne alors les compétences évaluées (elles figurent en jaune sur la feuille de calculs adossée à ce devoir ; les autres compétences ont été laissées pour permettre une adaptation facilitée de cette feuille à un autre devoir) ainsi que leurs poids respectifs. Ici, le domaine « communiquer » avec comme critères, la présentation des résultats avec un nombre de chiffres significatifs cohérent ou la qualité de la rédaction est évalué globalement sur l’ensemble du devoir (on a mis 0 comme poids aux domaines Com de chaque exercice pour privilégier l’évaluation globale du domaine). Il reste à placer les croix dans les colonnes respectives. On obtient alors automatiquement une note chiffrée que l’on peut arrondir au point ou au demi-point ainsi que le bilan de compétences du devoir (après avoir paramétré les cellules indiquant les pourcentages limites). Correction du DS par compétences Exercice 1 : 1. Deux atomes sont isotopes s’ils ont le même nombre de protons mais des nombres de neutrons différents. 2. Un proton porte la charge électrique +e ; un neutron est neutre. 3. La distance minimale qui sépare le centre d’un proton et le centre d’un neutron est égale à 2R soit 2,4 fm. 4. La distance minimale qui sépare les centres de deux protons s’obtient avec le théorème de Pythagore : dp-p = = 3,4 fm. 5. Interaction électrostatique entre deux protons : 19,9 N. 6. Représentation des forces d’interactions électrostatiques qui s’exercent entre deux protons : Flèches de 2 cm avec 10 N par cm : forces répulsives. 7. La force d’interaction électrostatique qui s’exerce entre un neutron et un proton est nulle (le neutron n’est pas chargé). 8. Interaction gravitationnelle : F = = 3,23.10-35 N. 9. La cohésion du noyau ne peut résulter de l’interaction gravitationnelle (attractive mais trop faible devant l’interaction électrique répulsive) mais d’une autre interaction (l’interaction forte) qui compense la répulsion électrique. Exercice 2 : 1. Parmi les deux solides présentés, le solide ionique est le fluorure de calcium (assemblage régulier et ordonné d’ions) et le solide moléculaire est le cristal moléculaire de diiode. 2. L’atome de carbone est moins électronégatif que l’atome de chlore. La liaison C–Cl est polarisée. De même pour la liaison O–H. 3. L’eau possède 2 liaisons O–H polarisées : il apparaît des charges partielles sur ces 3 atomes. Du fait de la géométrie coudée de la molécule, les centres des charges + et – sont distincts : la molécule est polaire. 4. Le tétrachlorure de carbone est un solvant apolaire. Il possède 4 liaisons C-Cl polarisées mais, du fait de la géométrie tétraédrique de la molécule, les centres des charges + et – sont confondus : la molécule est apolaire. 5. CaF2(s) Ca2+(aq) + 2 F-(aq) [F-(aq)] = 2 × C donc C = 5,0.10-2 mol.L-1. Exercice 3 : 1. Les pointillés entre les deux bases azotées représentent des liaisons hydrogène. 2. Une liaison hydrogène s’établit entre un atome d’H et un atome fortement électronégatif comme O, F, Cl, N. C’est le cas ici avec l’azote. 3. La liaison covalente est plus intense que la liaison H, elle-même plus intense que l’interaction de Van der Waals : les brins d’ADN ne seraient pas aussi solidement attachés s’ils étaient liés par des forces de Van der Waals. Exercice 4 : 1. Lors d’un changement d’état, il y a seulement rupture des interactions intermoléculaires. 2. Au sein des alcanes : forces de Van der Waals ; 3. Au sein des alcools : forces de Van der Waals et liaisons hydrogène. 4. Les liaisons intermoléculaires les plus fortes sont les liaisons H. 5. C’est le propane qui la température d’ébullition la plus basse. En effet, dans les alcanes ne s’exercent que les forces de Van der Waals alors que dans les alcools, il y a en plus les liaisons H qui s’établissent et ces dernières sont plus intenses que les interactions de Van der Waals. 6. Formule semi-développée et topologique du propan-1-ol : 7. Isomère du propan-1-ol : propan-2-ol 8. Classe du propan-1-ol : classe I. 9. a) Ce sont des isomères de constitutions car ils ont la même formule brute mais des formules semi-développées différentes. b) Au sein d’une même famille de composés, les températures de changement d’état augmentent avec la longueur de la chaîne (plus il y a d’atomes dans la chaîne et plus les interactions de Van der Waals sont intenses : il faudra fournir davantage d’énergie pour les rompre Teb plus importante). c) Au sein d’une même famille de composés, les températures de changement d’état diminuent, pour des isomères, quand le nombre de ramifications augmente (plus la chaîne est ramifiée et moins les molécules peuvent se rapprocher : l’intensité des forces de Van der Waals diminue et il faut fournir moins d’énergie pour les rompre Teb plus faible).