LES THERAPIES CIBLEES EN ONCOLOGIE
Une tumeur se développe à la suite d’une multiplication anarchique de certaines cellules. Ce dysfonctionnement résulte d’une accumulation de mutations de l’ADN qui sont prises en charge par les voies de réparation de la cellule. Cependant, lorsque la cellule devient cancéreuse, elle perd ses capacités de réparation et de contrôle du cycle cellulaire. Elle se divise anarchiquement et finit par former une masse appelée tumeur maligne.
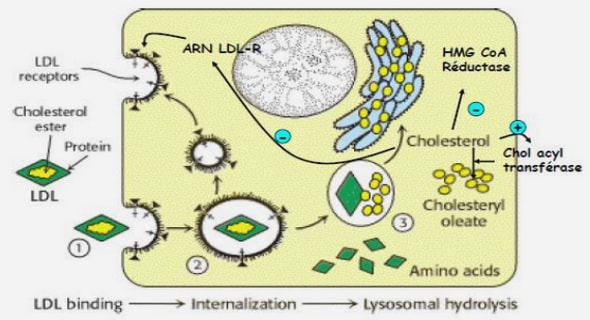
La plupart des médicaments de chimiothérapie dite classique agissent au niveau de l’ADN pour bloquer la réplication du génome. Les cellules qui ne peuvent plus se diviser finissent par mourir. On parle d’effet cytotoxique. Cependant, ces médicaments s’attaquent également aux cellules progénitrices saines qui se divisent rapidement comme les cellules du tube digestif, les cellules à l’origine des cheveux et des poils, les cellules germinales et les cellules de la moelle osseuse qui fabriquent les cellules du sang (globules blancs, globules rouges et les plaquettes). C’est la raison pour laquelle une chimiothérapie « classique » entraîne les effets secondaires suivants : troubles digestifs (nausées, vomissements, inflammation de la bouche ou aphtes, diarrhée ou constipation), alopécie, stérilité, asthénie, baisse des cellules du sang (leucopénie, anémie et thrombopénie). De récentes découvertes ont mis au point de nouveaux médicaments dont la façon d’agir est différente de celle de la chimiothérapie « classique » : les thérapies ciblées. Ces traitements s’appuient sur le fait que la tumeur présente des anomalies moléculaires qui lui sont spécifiques. Ils s’inscrivent au sein de la médecine personnalisée, qui a pour objectif de proposer au patient un traitement adapté aux anomalies de sa tumeur. Les thérapies ciblées ont pour objectif de bloquer la croissance ou la propagation de la tumeur, en interférant avec des anomalies moléculaires ou avec des mécanismes qui sont à l’origine du développement ou de la dissémination (formation de métastases) des cellules cancéreuses.
Il existe plusieurs approches de thérapie ciblée, incluant principalement les anticorps monoclonaux (suffixe –mab) et les petites molécules (suffixe –ib dont les inhibiteurs de tyrosine kinase). L’essor des thérapies ciblées a commencé dans le milieu des années 2000. En effet, en 2002, l’imatinib (Glivec®) a révolutionné le traitement de la leucémie myéloïde chronique (LMC). C’est incontestablement un progrès thérapeutique majeur de la dernière décennie en hématologie qui a transformé le pronostic de la LMC. À partir de 2006, l’utilisation du trastuzumab (Herceptin®) a permis de diminuer de moitié le risque de rechute pour les femmes atteintes de cancer du sein «HER2».
CONCEPT DU CIBLAGE THERAPEUTIQUE DES RECEPTEURS DU DEVELOPPEMENT EMBRYONNAIRE
Une voie de signalisation est une cascade d’évènements au sein d’une cellule impliquant plusieurs protéines de signalisation qui fonctionnent ensemble pour contrôler les fonctions biologiques cellulaires (croissance, division, différenciation, mort…). Les voies de signalisation sont déclenchées par l’interaction entre un ligand (peptides, hormones…) et un récepteur membranaire à la surface de la cellule.
Les voies de signalisation Hedgehog, WNT, Hippo, Notch sont mises en jeu au cours du développement embryonnaire. Elles jouent un rôle essentiel dans l’auto-renouvellement des cellules souches.
Chez l’adulte, ces voies de signalisation développementales (Hedgehog, WNT, Hippo, Notch) sont peu actives dans des conditions d’homéostasie. Cependant, elles sont réinitialisées dans les cancers pour permettre aux cellules tumorales de proliférer et migrer afin d’envahir d’autres tissus et pour résister aux traitements. Cela leur confère un avantage sélectif par rapport aux cellules normales. Les molécules de ces voies de signalisation étant presque exclusivement exprimées sur les cellules tumorales chez le patient adulte, elles constituent des cibles idéales de médicaments avec des effets secondaires en théorie limités.
Des stratégies de ciblage de certaines protéines de ces voies de signalisation ont d’ailleurs montré leur efficacité dans les premiers essais cliniques de phase I et II et deux inhibiteurs de la voie Hedgehog ont désormais l’autorisation de mise sur le marché (AMM) dans la prise en charge du carcinome basocellulaire.
Ces résultats encourageants soulignent l’importance des connaissances des processus biologiques fondamentaux impliqués dans l’embryogenèse et dans l’homéostasie adulte pour la conception de nouvelles stratégies thérapeutiques.
DEREGULATION DES VOIES DU DEVELOPPEMENT DANS LES CANCERS
VOIE DE SIGNALISATION HEDGEHOG :Ces dernières années, l’implication de la voie Hedgehog dans la cancérogenèse a été mise en évidence.
En effet, des mutations de certains de ses composants ont été documentées dans le médulloblastome (tumeur cérébrale maligne la plus fréquente de l’enfant), dans les carcinomes basocellulaires (cancers les plus fréquents de l’adulte qui représentent la majorité des cancers cutanés) et dans le rhabdomysosarcome (tumeur maligne des tissus mous, tumeur mésenchymateuse la plus fréquente chez l’enfant et l’adolescent) . De façon non surprenante, étant donné ces récentes découvertes, les composants de la voie de signalisation Hedgehog ont émergé comme des cibles prometteuses pour les thérapies ciblées .
VOIE DE SIGNALISATION NOTCH :Le rôle important de la voie de signalisation Notch dans le développement embryonnaire est connu depuis plus de 100 ans, mais son rôle dans l’oncogenèse n’est soupçonné que depuis une vingtaine d’années avec l’identification d’un réarrangement chromosomique impliquant le locus NOTCH1 dans un sous-groupe de leucémies lymphoblastiques aigües. Depuis, de nombreuses études ont démontré que la signalisation Notch exerce une activité oncogénique également dans les tumeurs solides. En effet, des mutations des gènes de la famille Notch (NOTCH1, NOTCH2, NOTCH3, NOTCH4, JAG1, JAG2, DLL1, DLL3, DLL4) sont fréquemment retrouvées dans de très nombreuses tumeurs solides (cancers de prostate, du pancréas, du poumon, du sein, du col utérin, du côlon, de l’estomac, du rein, de la thyroïde, ORL, glioblastomes, mélanomes, hépatocarcinomes, etc.) .
LA VOIE DE SIGNALISATION WNT CANONIQUE (WNT/Β CATENINE)
Comme la voie de signalisation Notch et Hedgehog, la voie Wnt intervient à différents stades du développement embryonnaire en participant de façon majeure aux processus de différenciation cellulaire et à l’organogenèse. La découverte de la voie Wnt date de plus de 40 avec l’identification du gène wingless chez la drosophile (Drosophila melanogaster).
Parmi les récepteurs de la voie Wnt, on compte des récepteurs couplés aux petites protéines G (RCPG) et des récepteurs à activité tyrosine kinase (RTK). Les ligands de la voie Wnt sont des glycoprotéines sécrétées au nombre de 19. La voie Wnt se divise en deux voies de signalisation: la voie β-caténine-dépendante également appelée voie canonique ou voie Wnt/β-caténine et la voie β-caténine-indépendante (voie non canonique).
Cette dernière est elle-même sous-divisée en deux voies : la voie Wnt/Calcium et la voie Wnt/Polarité planaire (PCP). Contrairement à la voie Wnt non canonique, la voie Wnt/β-caténine est très bien caractérisée au niveau moléculaire et en ce qui concerne son rôle dans les pathologies humaines. Les deux voies utilisent des ligands et récepteurs différents mais certains composés sont communs aux deux voies.
La voie Wnt β-caténine a pour effet de stabiliser le cofacteur de transcription β-caténine. En l’absence de Wnts : β-caténine est associée à un complexe de destruction composé d’adenomatous polyposis coli (APC), glycogen synthase kinase 3b (GSK3b), axin et caseine kinase 1 (CK1). β-caténine est phosphorylée par GSK3β et CK1 ce qui entraîne son ubiquitinylation par βTRCP et ainsi sa dégradation par le protéasome. En l’absence de β-caténine, des corépresseurs de la transcription (histones désacétylases) se lient au facteur de transcription LEF/TCF empêchant la transcription des gènes cibles de la voie Wnt β-caténine.
En présence de Wnts : Les ligands de la voie Wnt tels que WNT3A et WNT1 se lient au récepteur FRIZZLED et au corécepteur LRP entraînant la transduction d’un signal à travers la membrane plasmique. Ce signal conduit à l’activation de Disheveled (DVL) qui va inhiber le complexe de destruction de β-caténine entraînant l’accumulation de β-caténine dans le cytoplasme. β-caténine entre ensuite dans le noyau où elle va se lier à TCF/LEF déplaçant ainsi les corépresseurs de la transcription et recrutant des coactivateurs (histones acétyltransférases : CREB binding protein (CBP) et BCL9). Les gènes cibles de la voie Wnt canonique peuvent ainsi être exprimés . La voie Wnt/β-caténine est étroitement contrôlée, en particulier par un inhibiteur extracellulaire appelé DICKKOPF (DKK) et par R-spondin 3 qui est un activateur de la voie.
La voie de signalisation Wnt/PCP
Prolifération cellulaire et auto-renouvellement des cellules souches :Une récente étude sur une large cohorte de patients atteints de cancer colorectal métastatique a montré qu’une augmentation de l’expression du ligand de la voie Wnt/PCP WNT5A améliore leur pronostic vital . Dans cette étude, les xénogreffes de cellules de cancer colorectal HCT116 surexprimant WNT5A sont moins prolifératives et moins tumorigéniques que lorsque WNT5A n’est pas surexprimé. Le rôle de suppresseur de tumeur de WNT5A est dû à l’inhibition de la voie WNT canonique .
Cependant, dans d’autres études, WNT5A est décrit comme un marqueur de mauvais pronostic pour les patients atteints de cancer colorectal ou gastrique car il augmenterait la migration des cellules cancéreuses et leur pouvoir invasif . De même, la diminution de l’expression des récepteurs de la voie WNT/PCP PTK7 et VANGL1/2 diminue la prolifération des cellules de cancer du côlon et du sein respectivement .
La protéine SCRIBBLE joue un rôle indispensable dans la polarité apico-basale et se comporte comme un gène suppresseur de tumeur chez la drosophile car son inhibition entraîne une prolifération incontrôlée des cellules . Chez les vertébrés, SCRIBBLE est également un acteur de la voie WNT/PCP en plus de son rôle pour maintenir la polarité apicobasale . Sa fonction de gène suppresseur de tumeur est conservée dans le cancer du sein et de la prostate par l’inhibition de la voie MAPK et Hippo qui, dans certaines conditions, favorisent la prolifération des cellules cancéreuses et les capacités d’auto-renouvellement des cellules souches cancéreuses . Quant au récepteur PTK7, il a récemment été décrit comme marqueur de cellules souches cancéreuses pour le cancer du côlon et certaines tumeurs hématologiques .
Transition épithélio-mésenchymateuse (TEM) : Des études récentes ont attribué à SCRIBBLE un rôle direct dans la TEM en condition normale et pathologique (tumorale) .
Récemment, une élévation du niveau d’expression de WNT5A, WNT5B et FRIZZLED-2 a été observée dans plusieurs types de cancer métastatique (foie, poumon, côlon et sein) exprimant des marqueurs de l’EMT. Dans cette étude, FRIZZLED-2 induit la TEM et des métastases. C’est pourquoi les auteurs proposent de cibler FRIZZLED-2 chez les patients avec des tumeurs présentant des niveaux élevés de WNT5a/WNT5b et FRIZZLED-2.
Table des matières
CHAPITRE 1 : INTRODUCTION GENERALE
I. Les thérapies ciblées en oncologie
II. Concept du ciblage thérapeutique des récepteurs du développement embryonnaire
III. Dérèglement des voies du développement chez l’embryon et pathologies humaines congénitales
A. Voie de signalisation Hedgehog
B. Voie de signalisation Notch
IV. Dérégulation des voies du développement dans les cancers
A. Voie de signalisation Hedgehog
B. Voie de signalisation Notch
V. Essais cliniques
A. Essais cliniques et particularités en cancérologie
B. Voie de signalisation Hedgehog
C. Voie de signalisation Notch
VI. La voie de signalisation Wnt
A. La voie de signalisation Wnt canonique (Wnt/β caténine)
B. Voie de signalisation Wnt non canonique (WNT/PCP)
C. Synthèse de tous les inhibiteurs de la voie Wnt en essai clinique
D. Dérégulation de la voie de signalisation Wnt dans les cancers mammaires et colorectaux
1. La voie de signalisation Wnt/ β-caténine
a. Croissance tumorale
b. Auto-renouvellement des cellules souches
c. Transition épithélio-mésenchymateuse (TEM)
d. Migration cellulaire et caractère invasif des cellules tumorales
e. Apoptose, sénescence et résistance au traitement
2. La voie de signalisation Wnt/PCP
a. Prolifération cellulaire et auto-renouvellement des cellules souches
b. Transition épithélio-mésenchymateuse (TEM)
c. Migration cellulaire et caractère invasif des cellules tumorales
d. Interaction entre la tumeur et le microenvironnement tumoral
e. Résistance au traitement
VII. Le cancer du sein
A. Physiopathologie
1. Organisation de la glande mammaire
2. Les différentes tumeurs malignes
a. Les adénocarcinomes in situ
b. Les adénocarcinomes infiltrants
3. Classification moléculaire
B. Epidémiologie
C. Facteurs de risque
1. L’âge
2. Les antécédents personnels de maladie
3. Les antécédents familiaux de cancers
4. Les prédispositions génétiques
D. Diagnostic
E. Traitement
1. Carcinome du sein in situ
2. Cancer du sein infiltrant non métastatique
3. Cancer du sein métastatique
F. Les pistes de recherche actuelles
VIII. Le cancer colorectal
A. Physiopathologie
1. Organisation du côlon et du rectum
2. Les différentes tumeurs colorectales
B. Épidémiologie
C. Facteurs de risque
1. L’âge
2. Présence de polypes
3. Les antécédents personnels ou familiaux
4. La prédisposition génétique
5. Le mode de vie
6. Maladies inflammatoires
D. Diagnostic
E. Traitement
F. Les pistes de recherche actuelles
CHAPITRE 2 : PROTEINES DE LA VOIE DE SIGNALISATION WNT/PCP ETUDIEES AU LABORATOIRE
I. Généralités sur PTK7, un récepteur de la voie Wnt/PCP, dans les cancers colorectaux
II. Etude moléculaire de VANGL2, un récepteur de la voie Wnt/PCP, dans les cancers du sein
A. Introduction
B. Résultats
1. Caractérisation d’une nouvelle isoforme VANGL2-Long
2. Caractérisation du complexe VANGL2 à la membrane en condition physiologique et pathologique
C. Discussion
D. Matériels et méthodes
1. Biochimie
a. Western blot
b. Immunoprécipitation
2. Biologie cellulaire
a. Lignées cellulaires et culture
b. Transfection des cellules
3. Technologie Crispr/Cas 9
a. Biologie moléculaire
b. Transfection, sélection et isolation clonale des IMCD3 GFP+
4. Imagerie
a. Immunofluorescence (Cellules fixées)
b. Cellules vivantes (Live)
CHAPITRE III : CIBLAGE DE LA VOIE DE SIGNALISATION WNT
I. Thérapies ciblées en développement
A. Anticorps monoclonaux non couplés (« nus »)
1. Principe
2. Vantictumab (OMP-18R5) (cible : FRIZZLED 7)
B. Anticorps monoclonaux couplés
1. Principe
2. PF-06647020 (PF-7020) (cible : PTK7)
C. Protéines de fusion
1. Principe
2. ipafricept (OMP-54F28) (cible : FRIZZLED 8)
D. Petites molécules
1. Principe
2. Inhibiteurs de Porcupine
3. Agonistes de WNT5A
4. Autre petite molécule : PRI 724
II. Nouvelles thérapies potentielles
1. Oligonucléotides anti-sens
2. PROTAC (proteolysis targeting chimera)
III. Toxicité
CHAPITRE IV : CONCLUSION GENERALE
BIBLIOGRAPHIE
ANNEXE I