Cytométrie en flux
Dans le cadre de ces travaux, la cytométrie a été utilisée afin d’estimer la viabilité des microorganismes et de les quantifier dans un échantillon, ainsi que pour estimer l’intensité du signal FISH au cours du cycle de croissance. La cytométrie en flux (CMF) est une technique qui a vu le jour dans les années 50. Elle est définie comme l’étude de particules isolées (cellules, bactéries…) entraînées par un flux liquide. C’est une technique de caractérisation individuelle, quantitative et qualitative de particules en suspension dans un liquide. Elle consiste à analyser les signaux optiques ou physiques émis par une particule coupant le faisceau d’un laser ou d’une lampe à arc. Les signaux mesurés sont essentiellement relatifs : Ce procédé d’analyse individuelle (cellule par cellule) est multiparamétrique et peut s’effectuer à la vitesse de plusieurs milliers d’événements par seconde. L’ordinateur calcule les données statistiques associées aux distributions des paramètres mesurés et les représente sous la forme d’histogrammes (un paramètre) ou de cytogrammes (deux paramètres), sur une ou plusieurs populations dont les propriétés cellulaires sont ainsi évaluées. Certains cytomètres en flux permettent de trier physiquement une ou deux populations cellulaires définies par leurs propriétés optiques. L’analyse multiparamétrique d’une suspension cellulaire hétérogène permet de définir des sous-populations qui peuvent être séparées physiquement de la population globale. Pour cela, des critères de séparation sont déterminés par l’utilisateur (définition des zones d’intérêt du tri) et toute cellule dont les caractéristiques seront comprises entre les valeurs choisies, sera isolée. Dans ce but, la veine liquide sera chargée électriquement, puis fractionnée en une succession de gouttelettes. La gouttelette contenant la cellule à isoler est déviée en passant dans un champ électrostatique et récupérée dans un tube collecteur. Si la cellule appartient à une sous-population non sélectionnée ou si la gouttelette formée ne contient pas de cellule, la veine liquide ne sera pas chargée et la gouttelette éliminée.
Protocole expérimental
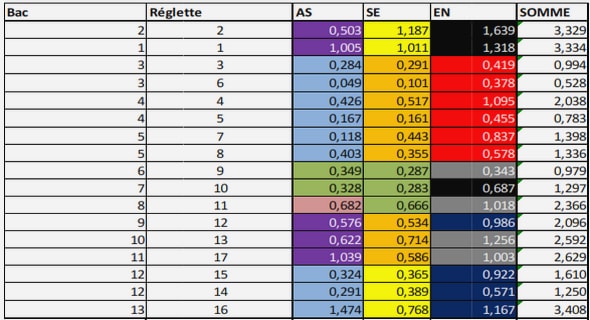
A différents moments lors de nos travaux, nous avons procédé à une quantification des microorganismes par cytométrie en flux. Avant analyse, les échantillons ont été marqués à l’aide de 5(6)-carboxyfluorescéine diacétate (cFDA). Le cFDA est une molécule hydrophobe qui devient fluorescente sous sa forme cF (5(6)- carboxyfluorescéine) après hydrolyse des groupements acétate (cf. Figure 32). La membrane cellulaire est relativement perméable au cFDA. Une fois dans la cellule, les groupements acétate sont clivés par des estérases aboutissant à la formation de molécules de cF hautement fluorescentes. Ces dernières restent dans les cellules du fait de leurs charges négatives. Le cFDA est un marqueur de viabilité, c’est-à-dire qu’il marque exclusivement les cellules vivantes. Il est le plus souvent utilisé afin d’étudier les mouvements de populations cellulaires, estimer la viabilité, et mesurer le pH intracellulaire. En effet l’intensité de la fluorescence est fonction du pH.
Un prélèvement de 1 mL est centrifugé à 13 000 rpm pendant 1 minute. Le culot cellulaire est ensuite repris dans 1 mL de tampon B4 (Chemsol), auquel sont ajoutés 10 µ L d’une solution de cFDA à 50 µM. Le tube est ensuite agité, incubé 10 minutes à 40°C, puis à nouveau centrifugé 1 minute à 13 000 rpm. Le culot est repris dans 1 mL de tampon B4 et analysé au cytomètre en flux. Le cytomètre utilisé pour la quantification et le test de viabilité est le BactiFlow multiparamétrique (Chemunex SA) équipé d’un laser argon émettant à 488 nm et refroidi par air. Il est équipé de 4 filtres différents, permettant d’analyser 4 paramètres simultanément : Le cytomètre utilisé pour l’analyse FISH est le FAC-Scan (Becton-Dickinson). Ses caractéristiques sont identiques à celle du cytomètre précédent sauf qu’il dispose en plus d’un filtre de bande passante à 585 nm (564-606 nm), qui collecte la fluorescence jaune-orange. Le suivi de la division cellulaire lors de la filamentation a été effectué grâce au marquage des cellules à l’aide de la 5-(6)-carboxyfluorescéine diacetate succinimidyl ester (cFDA/SE). Cette molécule est la plus utilisée pour le marquage fluorescent des cellules vivantes. Elle diffère du cFDA par la présence d’un groupement succinimidyl ester (SE) ayant une forte affinité pour les amines libres ainsi que pour les groupements amines des protéines intracellulaires. Le cFDA/SE est, comme le cFDA, hydrolysé en une molécule fluorescente, le cF/SE, par les estérases intracellulaires (cf. Figure 33).