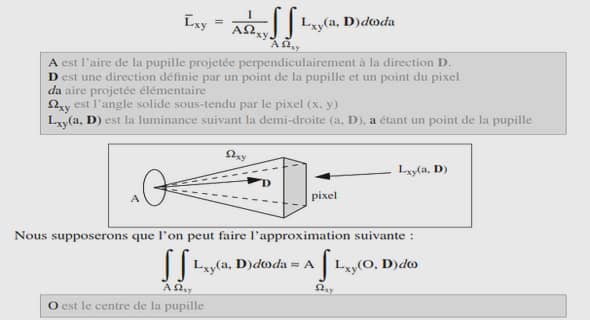
I – La liaison covalente
On rappelle que l’état énergétique d’un électron est représenté par sa fonction d’onde Yn,l,m (la probabilité de présence de cet électron dans cet état énergétique est proportionnelle à Y2n,l,m) et que toute combinaison linéaire des fonctions d’onde est aussi solution de l’équation de SCHRODINGER qui régit le système (voir partie Atomistique).
1. Le recouvrement orbital.
La figure présente le cas de 2 atomes d’hydrogène HA et H B
a /HA et HB avec leurs fonctions d’onde respectives YA et YB
b /La combinaison liante YL= YA+ YB et la fonction associée Y2
c / La combinaison anti-liante YAL= YA- YB et la fonction associée Y.2AL
La liaison covalente implique l’existence d’un doublet électronique commun constitué par le recouvrement de 2 orbitales atomiques contenant chacune 1 électron (une probabilité notable de la présence simultanée des 2 électrons se trouve définie dans cet espace commun).
Les différents types de liaisons chimiques (71,52 Ko) (Cours PDF)