CONSÉQUENCES DES INTERACTIONS PEPTIDES FLUORÉS-PROTÉINES SUR L’INHIBITION DE PROCESSUS BIOLOGIQUES
Parmi ces maladies, on retrouve la maladie d’Alzheimer, de Creutzfeldt-Jakob, de Parkinson ou le diabète de type II. La formation des fibres amyloïdes est associée à une mortalité cellulaire et une perte de fonction du tissu affecté. L’un des enjeux majeurs de la biologie moderne est de comprendre les bases moléculaires des processus conduisant au mauvais repliement des protéines et à leur agrégation. Jusqu’à présent, aucun médicament n’existe pour soigner ces maladies dues au mauvais repliement protéique. L’objectif de ce projet a été d’étudier l’interaction entre les peptides amyloïdes et de nouvelles molécules organiques capables d’agir sur la cinétique de formation des fibres amyloïdes. Il s’agissait principalement d’analyser l’effet de l’incorporation d’acides aminés α-trifluorométhylés énantiopurs de configuration (R) ou (S) dans des chaînes peptidiques, notamment sur la capacité à interagir avec des structures en feuillets β. Ces études d’interactions ont été réalisées à l’Université Pierre et Marie Curie par Alexandra Botz sous la direction du Dr. Lucie Khemtemourian (UMR 7203 Université Pierre et Marie Curie). Les diverses techniques biophysiques utilisées pour ce projet ont permis de suivre la cinétique de formation des fibres amyloïdes par fluorescence de la Thioflavine-T, d’étudier la structure secondaire du peptide par dichroïsme circulaire (DC), de caractériser les stades d’agrégation par RMN et enfin d’observer la morphologie électronique à transmission (TEM).
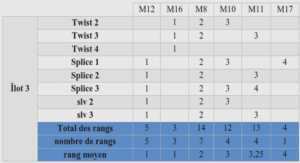
La pepsine est une endoprotéase peu spécifique clivant de préférence les liaisons peptidiques à proximité d’aminoacide aromatiques hydrophobes. Les séquences peptidiques envisagées pour l’étude incluent donc une α-Tfm-Alanine à proximité de ce type d’aminoacides. Les expériences de digestion ont été réalisées en comparaison avec un peptide analogue incorporant à sa place un résidu Alanine. Le suivi de ces expériences a été réalisé par l’observation La maladie d’Alzheimer altère la mémoire et les fonctions cognitives des malades et conduit progressivement à une démence, une déchéance physique et une perte d’autonomie, puis à la mort de l’individu atteint. Au niveau physiopathologique, la maladie d’Alzheimer est associée à l’accumulation progressive de deux protéines dans le cerveau, la protéine β-amyloïde (Aβ), présente sous forme d’agrégats extraneuronaux formant des amas couramment appelés « plaques séniles », et la protéine tau sous une forme anormalement hyperphosphorylée produisant des enchevêtrements neurofibrillaires intraneuronaux (NFT pour neurofibrillary tangles), qui vont mener progressivement à des dégâts neuronaux, axonaux et synaptiques. Ces changements neurologiques sont présents dans le cerveau plusieurs années avant l’apparition des symptômes cliniques de la maladie. Les NFT sont initialement localisés dans le lobe temporal moyen (cortex entorhinal et hippocampe) puis s’étendent dans les régions corticales associatives puis dans l’ensemble du cortex cérébral, alors que les plaques séniles sont plus disséminées dans le cortex.
Le délai entre les lésions neurologiques de la maladie et l’apparition Les dépôts amyloïdes nommés fibres amyloïdes ou plaques amyloïdes ont été les premières décrites. Il s’agit de dépôts extracellulaires que l’on retrouve entre les neurones et qui apparaissent comme des masses sphériques d’un diamètre de 5 à 100 micromètres. Ces fibres sont des solides non cristallins et non solubles, ce qui les rend incompatibles avec les techniques de détermination structurale habituellement utilisées telles que la cristallographie par rayons X ou la RMN en phase liquide. D’après les études de diffraction des rayons X et les mesures de RMN en phase solide (couplage 13C-13C et 15N-13C), les fibres amyloïdes auraient une structure en feuillets β croisés dans laquelle les segments tressés sont perpendiculaires et les liaisons hydrogènes intermoléculaires parallèles à l’axe de la fibre (Figure 52).159,160 Ces structures en feuillets β seraient essentiellement stabilisées par des interactions hydrophobes. Ces peptides circulent naturellement dans le plasma, le fluide cérébrospinal et le liquide interstitiel du cerveau, le plus souvent sous forme soluble Aβ 40. Les dépôts de fibres amyloïdes retrouvées dans le cerveau de patients atteints de la maladie d’Alzheimer sont eux constitués d’un mélange de peptides Aβ40 et Aβ42.
Bien qu’Aβ40 soit plus abondant dans le cerveau qu’à Aβ42, il est moins toxique, en partie parce que sa cinétique d’agrégation est plus lente in vivo pour conduire à la formation de plaques amyloïdes. Les plaques sont composées (Figure 54): La protéine Tau est normalement associée perpendiculairement aux microtubules, filaments du cytosquelette jouant un rôle prépondérant dans les mécanismes de transport intraneuronal du corps cellulaire vers les dendrites et les terminaisons de l’axone. Normalement, des protéines Tau se détachent périodiquement des microtubules, mais sont remplacées et rapidement dégradées chez le sujet sain. La maladie d’Alzheimer est caractérisée par des protéines Tau se détachant des microtubules et restant dans le milieu intracellulaire. Elles ne sont pas toutes dégradées et finissent par s’agréger et former les neurofibrilles. Trop de neurofibrilles bloquent le fonctionnement du neurone car elles ne permettent pas le transport axonal nécessaire à son activité. Les neurofibrilles compriment le neurone et provoquent une mort neuronale par apoptose.