Classification des TSNC
La classification des tumeurs du système nerveux central a beaucoup évoluée au cours des années. Les pathologistes avaient été confrontés à de nombreuses difficultés. Il s’agissait de problèmes liés à la complexité des tumeurs cérébrales, de problèmes de reproductibilité inter- observateurs, et de problèmes de reproductibilité intra-observateurs.
Historique des classifications
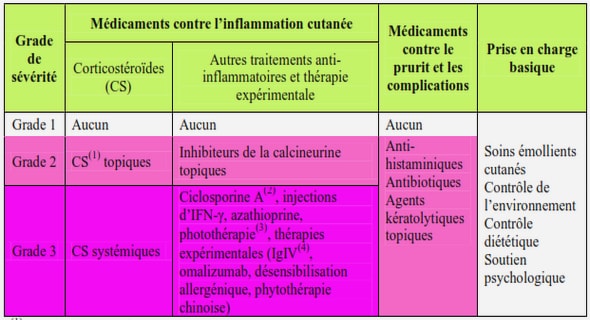
Les principaux temps marquant l’évolution de cette classification étaient les suivants:1926: Bailey et Cushing proposaient pour la première fois un modèle de classification des gliomes basé sur la morphologie histologique des cellules tumorales et la théorie des restes embryonnaires: les gliomes seraient issus de cellules embryonnaires prélevées à différents stades de l’embryogenèse. 1949: Kernohan et coll. relèvaient que les tumeurs gliales se développaient à partir de cellules adultes spécialisées, capables de se dédifférencier. La notion de classification en grade (ou stadification) en fonction de la malignité des lésions a été également ajoutée. 1979: L’OMS adoptait un consensus issu de ces deux classifications par un groupe d’experts neuropathologistes. La première classification officielle était basée essentiellement sur la localisation tumorale, l’histo-morphologie et le grade de la tumeur. Quatorze ans plus tard, la première révision de cette classification survenait par Paul Kleihues en 1993]. En 2000 une nouvelle classification était mise au point. Elle incorporait les premières données moléculaires (en tant que marqueurs pronostiques ou prédictifs) associées aux gliomes telles que l’hyperméthylation du promoteur du gène MGMT pour les glioblastomes ou la détection de pertes de régions chromosomiques 1p et/ou 19q et les tumeurs oligodendrogliales [34]. En 2007 la quatrième version de la classification de l’OMSLe grading des gliomes est basé sur la densité cellulaire, les atypies cytonucléaires, l’activité mitotique, l’activité angiogénique et la nécrose. D’où la notion de gliome de bas grade et de gliome de haut grade. Ces critères sont également utilisés pour le grading des autres TSNC. Plus le grade est élevé plus la tumeur est agressive. (cf. annexe 4 : classification histo-pronostic ou grading de l’OMS).
La classification de Sainte-Anne
La prise de contraste en imagerie est étroitement liée au degré d’hyperplasie endothélio- capillaire. L’IRM et le scanner permettent un véritable examen macroscopique car la prise de contraste est liée au degré de microangiogenèse et l’œdème péri tumoral est bien identifié par un hyposignal T1 et un hypersignal T2 en IRM et une hypodensité en TDM. Les tumeurs gliales sont des tumeurs primitives du SNC, constituées de cellules gliales de phénotype astrocytaire, oligodendroglial, intermédiaire voire indéterminé, dans des proportions variables et se développant au sein d’un tissu nerveux constitué d’astrocytes et d’oligodendrocytes non tumoraux.
Nous avons un aspect biphasique dans la forme typique. Il comporte une alternance de foyers compacts avec des foyers microkystiques. Les foyers compacts sont constitués de cellules tumorales allongées et dotées de longs prolongements ondulés. Ces cellules sont organisées en structures fasciculées. Nous avons des fibres de Rosenthal ainsi que des agrégats éosinophiles intracytoplasmiques de protéines gliales fibrillaires GFAP. Les foyers microkystiques sont composés de cellules astrocytaires protoplasmiques associées à de cellules oligodendrogliales. Une importante anisocaryose et même un aspect de nécrose avec prolifération endothéliocapillaire peuvent être visibles. Un infiltrat inflammatoire lymphocytaire, des éléments sidérophagiques, des calcifications et des remaniements fibro-hyalins sont parfois présents. Elle est constituée de cellules de grandes tailles, assez polymorphes. Les cellules sont arrondies, polygonales ou fusiformes à cytoplasme abondant, éosinophiles, vitreux ou hyalin. Leur noyau est excentré, vésiculaire à nucléole visible. Les différentes cellules tumorales ont tendance à s’organiser en pseudorosettes périvasculaires. Des infiltrats inflammatoires riches en lymphocytes T et en mastocytes semblent constants.
cytoplasmique claire ce qui leur donne un aspect typique dit « en œuf sur le plat ». Les vaisseaux sont volontiers rectilignes dit en « brèchet de poulet ». Les mitoses sont rares et le stroma conjonctivo-vasculaire est discret. Des microcalcifications, un réseau de capillaire ramifié et une dégénérescence myxoide peuvent être associés. Elle présente les caractéristiques d’un gliome de grade II. Les corps cytoplasmiques sont plus visibles, souvent éosinophiles conférant un aspect plasmocytoide ou pseudoépithélial à la prolifération tumorale. La présence de nécrose ischémique ou de type pseudo-palissadique est possible. Nous pouvons observer une anaplasie focale. Nous observons une discrète prédominance masculine. Ils peuvent siéger en n’importe quel point du cerveau avec cependant une prédilection pour les lobes frontaux, les lobes temporaux et les régions profondes et commissurales. Dans environ 5% des cas, il existe des localisations multiples (gliomes multifocaux).