Cours aspects physico-chimiques et influence des chlorures sur la durabilité des bétons, tutoriel & guide de travaux pratiques en pdf.
EFFETS DE L’EAU DE MER SUR LA DURABILITE DES BETONS
L’eau de mer, du point de vue chimique
La composition d’une eau de mer est très différente de la solution interstitielle d’un béton, à cause de ces différences de composition, des échanges ioniques vont se mettre en place.
Suivant les régions du monde, l’eau de mer peut avoir des compositions chimiques différentes. Elle se caractérise généralement par une grande concentration de sels dissous. La salinité peut varier de 10g.l−1 dans la mer Baltique, à 40g.l−1 dans la mer Rouge, voire pratiquement 400g.l−1 dans les mers Caspienne et Morte. Plus proche de nous, la mer Méditerranée a une salinité qui avoisine 40g.−l1 et l’océan Atlantique 35g.l−1.
Les sels dissous qui composent l’eau de mer sont généralement :
– le chlorure de sodium (NaCl), qui est prépondérant,
– le chlorure de magnésium (MgCl2),
– le sulfate de magnésium (MgSO4),
– le sulfate de calcium (CaSO4),
– le chlorure de calcium (CaCl2),
– le carbonate de potassium (KHCO3).
La concentration totale des espèces présentes dans l’eau de mer correspond à un pH qui varie entre 7,5 et 8,4 (Mehta, 1986).
Les plus grandes concentrations ioniques sont les Na+ et les Cl-, correspondant respectivement à 11.000 mg/litre (485,40 mmol/l) et 20.000 mg/litre (565,70 mmol/l). En réalité, le chlorure de sodium représente 75 à 85%,de la salinité d’une eau de mer. Par sa prépondérance dans un tel environnement naturel, cette solution est très souvent étudiée en prenant égale a zéro les concentrations de toutes esl autres espèces en solution.
Mécanisme de dégradation en environnement marin
Les environnements maritimes sont parmi les milieux naturels les plus agressifs vis-à-vis des matériaux à matrice cimentaire. En terme de composition chimique, la présence d’ions étrangers à la solution interstitielle, tels que les ions chlorures peut conduire à la formation de précipités, la dissolution ou la modification de la structure de certaines phases, au sein de la matrice cimentaire. A l’échelle de structure la dégradation du béton armé, est couramment due à des risques de corrosion prématurée des armatures, liés à la pénétration d’ions cl- ou d’un abaissement du pH de la solution interstitielle.
Suite à ce facteur de risque important, la pathologie principale qui apparait se traduit par une diminution progressive de la section des armatures, la dégradation de l’interface acier-béton, de plus la formation de rouille expansive exerçant une pression sur le béton entourant l’armature est souvent suffisante pour provoquer l’éclatement du béton d’enrobage.
L’intensité des dégradations qui sont normalement observées sont liées à l’agressivité du milieu (zone de marnage, d’éclaboussures, d’embruns) et peuvent être de nature physique ou chimique (figure II-1). Dans la partie immergée, le matériau béton est constamment saturé. L’agression chimique due à l’eau de mer y est prépondérante. Cette zone se caractérise par une évolution importante de la microstructure de la pâte de ciment. En particulier, il se forme de nouveaux composés expansifs qui peuvent éventuellement causer des gonflements et de la fissuration à l’intérieur de la structure en béton.
L’alternance des marées provoque, dans la zone de marnage des dégradations de nature physique et chimique : l’abrasion des surfaces dues à l’action mécanique des vagues, la marée, les fissurations engendrées par le gonflement et le retrait causés par les cycles de mouillage/séchage ; les conditions atmosphériques (le gel, le vent, le soleil) et la corrosion électrochimique des aciers s’ajoutent aux problèmesd’ordre chimique.
Figure II-1 : Conditions d’exposition en environnement marin (CEB, 1989).
En partie totalement émergée, le matériau est soumi aux embruns et par conséquent à une alternance de cycles de séchage/humidification, initiant la corrosion des armatures en béton armé qui induisent une fissuration du matériau.
La figure II-2 illustre bien les dégradations des structures en béton armé, soumise aux embruns, pour lesquelles tous les voiles (figure II-2 a) et ou poteaux (figure II-2 b) en béton armé sont fissurés et, à certains endroits, les armatures sont visibles et fortement corrodées.
(a) quai en zone de marnage (France).
(b) Colonnes d’un pont ravagées par corrosion (France).
Figure II-2 : Endommagement de structure causée par corrosion.
Dans le cadre de ce mémoire, nous nous intéressons plus particulièrement aux phénomènes de transport par diffusion qui n’entrainent que des dégradations de type chimique.
Conséquences des ions cl- sur les matériaux cimentaires – évolution de la microstructure –
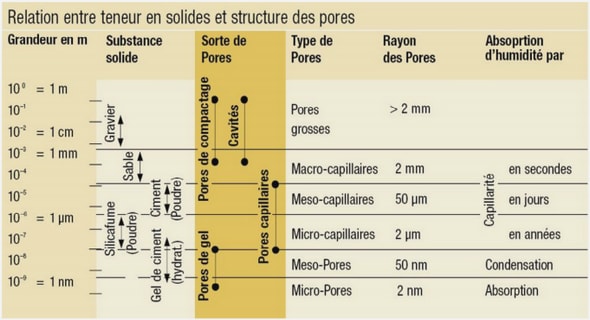
Dans les matériaux cimentaires, les ions chlorures peuvent se combiner avec les composés hydratés du ciment. En fait, les chlorures peuvent se présenter sous différents états dans la structure interne du béton, soit liés physiquement [1] ou chimiquement à la pâte de ciment hydratée ou sous forme de chlorures libres dans la solution interstitielle des pores.
Les ions Cl- qui diffusent dans le milieu poreux du béton modifient l’équilibre thermodynamique du système solution interstitielle/phase solide. Ils rendent la solution interstitielle acide, c’est à dire que la concentration en ion OH-, Ca2+ diminuent, favorisant ainsi la décalcification des hydrates et la lixiviation (Ramachandran et col,1990) de ces produits, pour rééquilibrer la solution interstitielle des pores.
De point de vue chimique, la diffusion de tels ions provoque la dissolution du monosulfoaluminate (issu C3A et C4Af) et la formation de chloroaluminate de calcium (aussi désigné par sel de Friedel), selon la formule suivante :
4 Ca 2 + 2 Al OH 4 + 2 Cl + 4 OH + 6 H 2O ® 3CaO × Al2O3 .CaCl2 ×10 H 2O (II-1)
Et pour tenir compte de l’influence des éventuels composés anhydres, il faudrait ajouter aux chloroaluminates issus de la dissolution de l’AFm, les chloroaluminates issus de l’hydratation du C3A résiduel en présence d’ions chlore.
Parallèlement, puisque la solution agressive ne comporte pas d’ions calcium, le départ de ces ions de la solution interstitielle vers l’extérieur provoque la dissolution de la portlandite, puis la décalcification progressive des C−S−H. De m ême, ces réactions chimiques, peuvent entrainer la formation de composés expansifs comme le trisulfoaluminate de calcium (Ca3Al2O6.3CaSO4.31H2O) ou l’ettringite[1] qui peut éventuellement causer des gonflements et de la fissuration à l’intérieur de la structure de béton (Regourd, 1980).
Il ressort aussi, puisque les concentrations en sulfate et en aluminium sont nulles dans la solution agressive, il a été observé une dissolution partielle de l’ettringite et du chloroaluminate, à long terme.
A noter que l’évolution de la porosité augmente à cause des dissolutions progressives de la portlandite[2], puis des autres phases comme les C−S−H; avec un a baissement du niveau d’alcalinité de la solution interstitielle, et une diminution de la résistance mécanique.
Par surcroit, si les chlorures sont présents en quantité suffisantes dans la structure poreuse, la dissolution des composés riches en calcium et la formation d’éttringite secondaire expansive sont toutes deux des causes importantes de dégradation des bétons au contact d’un milieu marin. Cependant, le problème de corrosion est la principale cause de dégradation des bétons exposés dans les environnements salins. C’est un phénomène très complexe qui fait intervenir un certain nombre de paramètres que nous traiterons dans le prochain paragraphe.
MECANISME DE LA CORROSION INDUITE PAR LA PENETRATION DES CHLORURES
La pénétration des ions chlorures
Les chlorures présents dans le béton peuvent provenir de deux sources différentes. Soit ils sont présents au moment du gâchage : utilisation d’ eau contenant des chlorures ou agrégats contaminés ou parfois de certains adjuvants. Soit ils proviennent le plus souvent de l’environnement extérieur : atmosphère marine ou sels de déverglaçage, qui diffusent dans le béton.
Comme il a été déjà évoqué précédemment (§ II.2.3),les chlorures existent sous deux formes dans le béton : les chlorures libres qui sont dissous dans la solution interstitielle et les chlorures piégés ou liés qui sont combinés à des hydrates du ciment ou adsorbés sur les parois des pores. Cependant les chlorures qui ne sont pas fixés aux hydrates c’est-à-dire les chlorures libres peuvent migrer à travers la structure poreuse du béton, sous l’effet des variations d’humidité consécutives aux alternances de cycle de séchage/mouillage ou sous l’effet de gradients de concentration entre la structure interne du matériau et l’eau de mer, par exemple.
En conséquence, ce sont les ions libres qui sont les plus nocifs en ce qui concerne la corrosion des armatures.
Ainsi la cinétique de pénétration ou plutôt béton. Elle décroit avec le rapport E/C solution interstitielle.
de migration de ces ions est relié à la porosité du et en fonction de la concentration en sels de la
Dépassivation des aciers dans le béton
Lorsque les aciers sont noyés dans le béton frais, la solution alcaline des pores du béton produit une oxydation rapide en surface de l’acier pour former une couche d’oxyde, appelé film passif (Rosenberg et col., 1989), (Bentur et col., 1999).
Le processus de corrosion des armatures par la présence des ions agressifs, particulièrement les ions chlore s’amorce lorsqu’ils traversent le béton d’enrobage et atteignent le premier lit d’armature en concentration suffisante pour dépassiver l’acier. Le seuil critique de dépassivation est généralement relié à la concentration critique de chlorures habituellement exprimée en pourcentage de masse du liant ou en pourcentage de la masse totale de béton (ACI 222R)
Dans les deux cas, la masse de chlorures considérés dans les calculs correspond à la masse totale de chlorures (i.e. chlorures liés et libres) trouvée dans le matériau. Selon les données publiées, certains auteurs préfèrent exprimer la concentration limite comme un ratio entre la concentration en chlorure libre (trouvé dans la solution) et les ions hydroxyde (OH-); selon Hausmann (1967) le rapport [Cl-]/[OH-] est proche de 0.6, cette méthode semble plus précise, considérant que la réaction de corrosion est sensible au pH de la solution des pores autour des armatures (Bentur et col., 1999). Selon Raharinaivo (1986), cette limite serait atteinte lorsque [Cl-]=[OH-], mais dépendrait fortement de la porosité et la distribution de la taille des pores. Toutefois, les plus gros pores jouent naturellement un rôle très négatifs, ce qui n’est pas le cas des ciments à constituants secondaires à caractère pouzzollanique notamment la fumée de silice, puisque [OH-] diminue et augmente la solubilité du sel de friedel.
D’autres auteurs suggèrent que la concentration critique est influencée par la qualité, et au changement de nature des produits d’oxydation à la surface de l’acier. Par exemple, dans une revue du sujet, Alonso et col. (2000) trouvent que la valeur de concentration critique de chlorures par masse de liant pour un acier standard (acier noir) varie entre 0.25% et 6.0%.
A noter que dans le cas des bétons carbonatés, le seuil de dépassivation est atteint plus facilement [1]. En effet, une concentration en chlorures 104 fois plus petite suffit à initier la corrosion dans un matériau carbonaté, ce qui est confirmé expérimentalement par Chaussadent et Dron (1992).
Enfin, Il reste difficile de définir précisément cette concentration critique susceptible d’amorcer la corrosion des armatures. L’influence de différents facteurs comme la composition du béton, la teneur en C3A, le rapport E/C, l’humidité relative, la température, la microstructure en contact avec l’acier et l’état de surface de l’acier sont autant de facteurs à cette variabilité.
L’amorçage et la propagation
La dégradation du béton armé comporte deux phases uccessives (Tutti, 1990) (voir figure II-3) :
une phase d’incubation (dite parfois d’amorçage) qui correspond à l’altération lente du béton, due à des modifications chimiques et parfois physiques (liés à la microstructure) de l’enrobage de béton, sans aucune constatation visible à l’échelle macroscopique, cette phase s’arrête lorsque les produits formés par les réactions internes du ciment atteignent un volume critique provoquant un gonflement néfaste du béton ou lorsque l’enrobage de béton ne protège plus les aciers contre la corrosion.
Une phase de développement (dite parfois de propagation) est celle où les dégradations du matériau sont visibles. Cependant, si l’enrobage est chimiquement modifié, l’acier se recouvre de produits “ intermédiaires ” qui ne sont pas stables en présence d’oxygène dissous dans le béton. Ils se transforment en des produits “ finaux ” non protecteurs, ce qui conduit à la dissolution et à l’enrouillement continus de l’acier. C’est pourquoi, les dégradations par corrosion des armatures produisent des défauts qui ne deviennent visibles qu’après un certain délai.
Vitesse de pénétration des agents agressifs
Figure II-3: Evolution du niveau de corrosion des armatures en fonction du temps (Bamforth, 1997).
Bamforth (1997) a expliqué le phénomène en proposant un modèle de propagation divisé en quatre stades (figure II-3). La corrosion démarre en un premier temps avec une dissolution des armatures qui se produit, sans aucune trace visible sur le parement, mais atteint un niveau conséquent au deuxième temps, marqué par l’apparition des fissures parallèlement au lit d’armatures longitudinales ou de la formation d’une fine couche de rouille sur l’acier avec des traces nettement visibles, la perte de section est effective au troisième stade, il s’agit aussi du début d’un éclatement (délaminage)de l’enrobage du béton, tandis que la structure perd de son intégrité au dernier temps, par la constatation de certaines dégradations pathologiques tels les éclatements, les épaufrures et des fissures avec la perte d’adhérence acier-béton. D’autres mécanismes peuvent également être à l’origine de ce type de désordres, lorsque la corrosion est très avancée, les armatures peuvent être mises à nu et leur dissolution est nettement constatée.
La durée de la phase d’initiation est primordiale pour la conservation des armatures mais reste difficile à déterminer. Par ailleurs, le béton et les ouvrages eux-mêmes doivent être conçus pour retarder ou empêcher au maximum la dépassivation des aciers.
La cinétique de corrosion [1] est influencée par de nombreux paramètres communs aux deux étapes, tels que la perméabilité du béton, l’épaisseur d’enrobage, mais aussi l’humidité relative et les effets thermiques, etc… D’autres fa cteurs comme les gradients de concentration qui assurent la diffusion des espèces agressives ou la capacité de fixation des ions cl- par les composés du ciment, sont propre à la période d’amorçage.
Processus électrochimique de la corrosion
Il est d’abord important de souligner que la durabilité des structures est conditionnée par le béton qui protège physiquement et chimiquement l’acier de la corrosion. En effet, la forte alcalinité (pH = 13) de la solution interstitielle contenue dans les pores du béton permet la formation d’un film passif [2] extrêmement mince et adhérent, constitué d’oxydes et d’hydroxydes de fer qui protège les aciers de la corrosion.
Au cours du temps, les chlorures qui diffusent dans la solution interstitielle du béton, peuvent traverser la barrière physique que constitue le béton d’enrobage, perturber la stabilité chimique et détruire le film passivant qui protège les armatures.
La destruction de cette protection se produit localement sur les surfaces les plus sensibles, ce qui conduit à l’apparition de piqures qui deviennent de petites anodes formant des piles de corrosion active ou l’acier est dissout. Le reste de la surface qui est encore passivée correspond aux zones cathodiques. Les zones anodiques et cathodiques de ces piles sont reliées par l’électrolyte qui est constitué par l’intermédiaire de la solution interstitielle du béton. Dans un tel milieu, l’acier passivé voit alors son potentiel électrique chuter vers les valeurs négatives, et une différence de potentiel électrique se développe le long de l’armature, il y a une création d’une pile électrochimique.