Evaluation de la cinétique et du rendement de digestion sur la BSA
Applications à l’identification des protéines
Le protocole de préparation d’échantillon complexe pour une analyse bottom-up est long. Sa miniaturisation dans un dispositif microfluidique n’est pas simple. Outre l’ajout de l’échantillon, au moins 2 réactifs (IAM et DTT) et l’enzyme doivent être ajoutés durant le protocole, puis être éliminés. Ceci implique le développement d’une plateforme microfluidique possédant au moins 5 réservoirs, un système de vanne et un mode d’actuation contrôlable. Une puce microfluidique intégrant toutes ces structures serait complexe aussi bien au niveau de l’usinage qu’au niveau du fonctionnement, et ce notamment pour les études d’optimisation. Nous avons donc opté pour une stratégie plus directe pour évaluer notre dispositif, et de garder la puce microfluidique simple en utilisant des équipements extérieurs pour assurer les fonctions de réservoir, vanne et actuation. Tous ses équipements sont connectés à un ordinateur permettant leur automatisation.
Ce chapitre comprend une description des différents composants microfluidiques utilisés et le montage réalisé pour l’utilisation de la puce. Ensuite, la présentation du protocole de traitement sur puce utilisé est suivie par l’exposition des résultats issus de la digestion de la BSA et d’échantillons complexes. Les performances du ChipFilter ont été évalués en le comparant aux méthodes conventionnelles (digestion en solution, FASP). Pour finir, Les résultats de cette comparaison vont aussi être discutés dans ce chapitre.
Installation microfluidique
pompe externe pour 2 raisons majeures. La première est que la présence de la membrane de filtration moléculaire entraine une résistance hydrodynamique trop importante pour être compatible avec les modes d’actuation par capillarité et par électro-osmose. La seconde raison est liée au besoin de contrôler la pression et le débit durant le protocole de préparation d’échantillon. Le contrôle de la pression permet d’assurer l’intégrité de la puce et de son fonctionnement.
Par ailleurs, contrôler le débit permet de calculer la quantité d’échantillon ou de réactif ajoutée et de déterminer le temps d’exposition des protéines à un réactif donné (temps de réaction). Durant cette étude, nous avons utilisé une pompe MFCS et un contrôleur de débit Flow-EZ de Fluigent. Dans l’installation microfluidique définitive, c’est une pompe Flow-EZ associé à un contrôleur de débit Flow- Unit-S qui ont été utilisés. La gamme de pression de la pompe est de 0 à 1000 mbar tandis que le contrôleur de débit fonctionne entre 0 et 7 µL/minute.
Vanne M-switch : Le M-switch est une vanne possédant une vanne multidirectionnelle, avec 10 entrées et une sortie. Cette configuration permet d’opérer des injections séquentielles depuis 10 réservoirs différents. Ceci permet de réaliser des injections depuis les tubes d’échantillon, de réactifs, d’enzyme et de solution de rinçage pour automatiser le protocole bottom-up complètement. de la pression. Un split connecté à la pompe permet de pressuriser 4 tubes en même temps. Tous les tubes sont connectés à la vanne M-switch. La sortie de ce dernier est reliée au contrôleur de débit Flow-Unit-S. Le ChipFilter est connecté à la sortie du contrôleur de débit.
Evaluation de la cinétique et du rendement de digestion sur la BSA
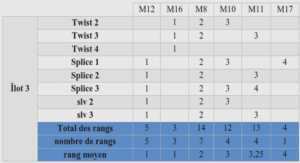
Le protocole a ensuite été appliqué à une protéine standard, la BSA, ou albumine bovine. La BSA est une protéine très utilisée pour les tests de digestion et de séquence parfaitement connue. C’est une protéine de 66.4 kDa possédant 17 ponts disulfure. Elle a été solubilisée dans une solution d’ABC 50 mM pour les tests de la digestion sur puce. Pour les premiers tests de digestion, un volume de 100 µL d’une solution d’1 mg/mL a été chargée dans la puce. Ce qui correspond à 100 µg de protéine digérée. Les concentrations des réactifs sont les mêmes que pour une digestion classique.
La réduction est effectuée avec une concentration de 20 mM de DTT et 200 mM d’IAM pour le blocage des cystéines. Le rapport enzyme/protéine appliqué pour une digestion classique est compris entre 1/50 et 1/25. Pour la digestion sur puce de la BSA, un rapport de 1/20 a été appliqué. Ce premier test a donné un pourcentage de couverture de la BSA assez satisfaisant témoignant d’une bonne efficacité de digestion. effectuées et comparées à une digestion sur FASP selon le protocole classique qui se fait sur la nuit. La comparaison s’est effectuée à travers le pourcentage de couverture de la BSA.
Pour éviter tout risque de contamination croisée aboutissant à une superposition de signal d’une analyse à l’autre, chaque digestion est effectuée avec une nouvelle puce, leur reconditionnement pour recyclage n’étant pas encore testé et validé. Un pourcentage de couverture de 30% en moyenne est observé pour une digestion de 10 minutes (Figure 30). Le pourcentage de couverture augmente avec la durée pour atteindre 88% pour une heure de digestion, légèrement supérieur au pourcentage obtenu avec la méthode classique qui dure 16 h. La digestion sur puce permet d’obtenir un meilleur pourcentage avec un temps de digestion plus court. Une digestion d’une heure a donc été choisie pour déterminer la sensibilité de la puce en diminuant progressivement la quantité de protéine.