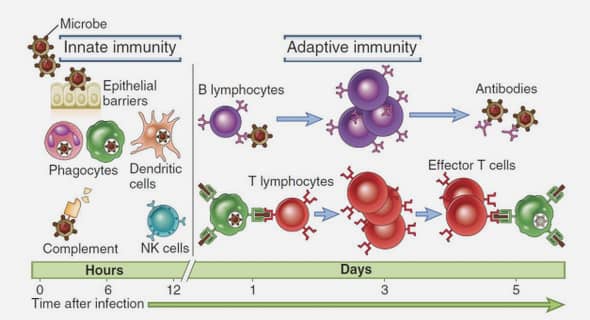
Altérations immunes dans les leucémies aigües
myéloïdes
Les leucémies aiguës myéloïdes (LAM)
Les LAM regroupent un ensemble hétérogène d’hémopathies, toutes définies par la prolifération maligne de progéniteurs des cellules sanguines, présentant un blocage de maturation, c’est-à-dire ayant perdu leur capacité de différenciation. L’accumulation dans la moelle osseuse de ces blastes leucémiques affecte la production physiologique des éléments figurés du sang. L’hématopoïèse n’étant plus efficace, des cytopénies parfois profondes apparaissent, comme par exemple thrombopénie, neutropénie et/ou anémie. La symptomatologie en lien avec ces cytopénies peut être plus ou moins marquée : syndrome hémorragique, infectieux ou anémique, amenant le patient à consulter et effectuer un bilan biologique. L’anémie et la thrombopénie sont fréquemment retrouvées mais le nombre de leucocytes varie quant à lui : de la leucopénie franche avec neutropénie à l’hyperleucocytose majeure avec blastes circulants. Le diagnostic de LAM repose sur l’examen cyto-morphologique de la moelle osseuse et du sang, ainsi que la numération des blastes (supérieur à 20%) dans la moelle osseuse. L’analyse morphologique des blastes a donné lieu à une première classification en 19762 en 7 catégories de LAM [Table 1]. Plus récemment, cette analyse a été complétée par l’étude de marqueurs immunophénotypiques, et surtout de la génétique, pour former la classification de l’Organisation Mondiale de la Santé (OMS) des néoplasies myéloïdes et leucémies aigues3 . Revue en 2016, cette classification illustre bien la complexité et l’hétérogénéité des hémopathies regroupées dans l’appellation leucémie aiguë myéloïde [Table 2]. 2. Stratification pronostique des LAM Il a été largement démontré que l’âge des patients au diagnostic de LAM est un facteur pronostic indépendant, avec une moins bonne survie pour les patients les plus âgés. Ainsi d’après les données de l’Institut national du cancer aux Etats-Unis recueillies entre 2000 et 2007, la survie à 5 ans chute de 53,9% pour les moins de 45 ans à 5,2% pour les plus de 65 ans (Figure 1A). Les données statistiques des années antérieures, remontant jusqu’à 1975, montre que les progrès médicaux, ont permis d’améliorer la survie à 5 ans de tous les patients confondus de 6,2% en 1975 à plus de 23% au début du 21e siècle (Figure 1B). Un plus grand nombre de patients atteignent donc la rémission complète, mais en conséquence un plus grand nombre vont également rechuter. C’est pourquoi il est nécessaire de trouver des outils performants pour évaluer le risque de rechute chez les patients. Le développement de la génétique puis des techniques de biologie moléculaire ont permis d’identifier des anomalies corrélées à la survie des patients. Initialement les analyses cytogénétiques ont permis de stratifier les patients en 3 groupes : Favorable, Intermédiaire et Défavorable, en fonction des anomalies cytogénétiques acquises, dépistées au diagnostic. La biologie moléculaire a permis d’affiner cette classification avec la recherche de mutation sur les gènes CEBPα, NPM1, FLT3, et plus récemment des gènes ASXL1, RUNX et TP53 pour les patients du groupe intermédiaire. Lorsque les patients présentent une mutation NPM1 ou CEBPα bi-allélique en l’absence de mutation FLT3-ITDhigh ils sont reclassés dans le groupe favorable. Ceux ayant une mutation FLT3-ITDhigh quel que soit leur statut NPM1 et CEBPα sont maintenus dans le groupe intermédiaire. Des mutations portant sur ASXL1, RUNX ou TP53 entrainent le reclassement de ces patients du groupe de pronostic intermédiaire dans celui de mauvais pronostic [Table 3]. Récemment revue par l’European Leukemia Network (ELN)5 et illustrée en Figure 2, cette stratification permet ensuite d’orienter la prise en charge des patient.
Traitements des LAM
Les patients sont traités par chimiothérapie, avec une première phase d’induction très agressive qui vise à obtenir une rémission complète (RC) rapidement. Cette phase, selon un schéma « 3+7 », consiste à administrer une anthracycline pendant 3 jours et de la cytarabine pendant 7 jours continus6 . Si les patients ne peuvent pas être traités intensivement, des alternatives sont proposées [Table 4]. La seconde phase du traitement, composée de cytarabine à dose intermédiaire (IDAC) est une phase de consolidation pour assurer une rémission prolongée. Durant cette phase, les patients de mauvais pronostic sont considérés comme à haut risque de rechute, c’est pourquoi l’allogreffe de cellules souches hématopoïétiques (CSH) est recommandée dès l’obtention de la rémission complète. Cependant cette thérapeutique ne peut être proposée à tous les patients car les patients âgés ou ayant des comorbidités ne sont pas éligibles à la greffe. La greffe est par ailleurs conditionnée par l’existence d’un donneur compatible, et le conditionnement du patient pour recevoir le greffon a une toxicité importante, avec environ 30% de décès post-greffe liés au traitement en lui-même7 . Concernant les patients de pronostic intermédiaire, il a été montré une hétérogénéité importante au sein du groupe ; en effet certains d’entre eux vont rechuter rapidement alors que d’autres maintiendront une rémission complète plus prolongée. C’est pourquoi la prise en charge thérapeutique de ces patients n’est pas encore consensuelle. Pour les patients de bon pronostic, la greffe n’apporte pas de bénéfice en termes de survie, la chimiothérapie est suffisante pour induire une rémission complète prolongée. L’indication de greffe est donc clairement établie pour les patients de mauvais pronostic, et clairement écartée pour ceux de bon pronostic, mais reste discutable pour ceux se situant dans le groupe de pronostic intermédiaire, qui représentent près de 50% des patients atteints de LAM. C’est pourquoi, une meilleure évaluation du risque de rechute chez ces patients, et donc d’un bénéfice potentiel de l’allogreffe de CSH, est nécessaire.
Liste des abréviations |