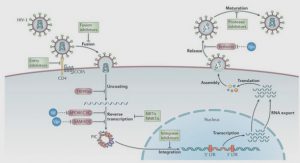
REACTIVITE DE SURFACE DES NANOPARTICULES ULTRAFINES – L’EFFET ‘NANO‘
Résumé étendu de l‘article
Ce chapitre est consacré à la compréhension des propriétés de surface et de la réactivité des nanoparticules d’oxyde avec leur environnement. Comme nous l’avons montré dans le chapitre I, un des intérêts de l’utilisation des nanoparticules manufacturées dans les applications environnementales réside dans leur forte capacité de rétention de polluants. Des nano-oxydes de fer de 6nm de diamètre, peuvent retenir 10 fois plus d’ions en surface que des particules de 300 nm. Ceci est lié en partie à leur importante surface spécifique. Mais il serait réducteur d’expliquer cette capacité d’adsorption à la simple augmentation de la suface spécifique. En effet, un deuxième paramètre à prendre en compte est la forte réactivité de surface des nanoparticules (i.e. la capacité d’adsorption par nm2 de surface).
Le cœur de ce chapitre est centré sur la réactivité de surface de nanoparticules d’oxydes de fer de diamètre inférieur à 10 nm. Cette problématique a vu le jour avec des études récentes révélant que bien que des oxydes de fer de taille microscopique retenaient en moyenne 1 à 4 atomes par nm2 (AlAbadleh et al., 2003 ; Sigg et al., 2000), des nano-magnétites ou nano-maghémites de 10 nm de
diamètre pouvaient retenir jusqu’à 10 As III/nm2 (Yean et al., 2005), 13 AsV /nm2 (Yean et al., 2005) ou encore 22 à 34 CoII/nm2 (Uheida et al., 2006). Ces études laissent supposer que les mécanismes d’adsorption à la surface de nanoparticules sont différents des mécanismes « classiques » se produisant à la surface de microparticules. Mais la nature de ces mécanismes et l’origine de cet effet ‘nano’ reste encore mal connu. L’objectif de ce chapitre a été de les identifier.
Pour cela, notre attention s’est portée sur les nano-maghémites qui présentent l’avantage d’être chimiquement stables en solution et d’avoir une structure spinelle symétrique qui facilite la compréhension des mécanismes structuraux se produisant en surface. L’arsenic trivalent a été choisi pour sonder la surface des nano-maghémites du fait de sa forte affinité pour la surface des oxydes de fer. Bien que l’adsorption de l’arsenic par les oxydes soit largement documentée dans littérature (e.g. Manceau et al., 1994 ; Waychunas et al., 1995 ; Wilkie et al. 1996 ; Manning et al., 1998 ; Roddick et al., 2001 ; Randall et al., 2001 ; Deliyanni et al., 2002) peu d’études ont concerné son adsorption à la surface de nanoparticules ultrafines. Pourtant, comme l’illustrera ce chapitre, nous ne pouvons pas faire un simple transfert des connaissances sur les réactions se produisant à l’interface microparticules/solution vers celles se produisant à l’interface nanoparticules/solution.
Nos travaux ont mis en évidence deux paramètres expliquant l’effet ‘nano’ à l’origine de la grande capacité d’adsorption de l’arsenic par les nano-oxydes de fer. Le premier est lié à une modification structurale de la surface des particules lorsque la taille diminue. Le deuxième est en étroite relation avec les propriétés thermodynamiques des nano-systèmes.
Des études ont montré que lorque la taille des particules de maghémite diminue la structure atomique de la surface est modifiée. Alors que les microparticules de maghémite ont une surface composée d’octaèdres et de tétraàdres de fer, les nano-maghémites ont une surface préférentiellement octaédriques (Brice-Profeta et al., 2005). Il existe alors à la surface des nano-maghémites des sites lacunaires tétrahédriques. Cette modification structurale de la surface crée ainsi des sites d’adsorption potentiels « peu classiques » à la surface des nano-maghémites. Nous avons pu montrer que lors de son adsorption, l’As III comblait ces lacunes tétraédriques. Deux sites d’adsorption ont été mis en évidence par XAS au seuil de l’As : (i) un site situé en surface d’un cycle constitué de plusieurs octaèdres de fer et (ii) un site en surface d’un trimère d’octaèdres de fer (Figure III.1).
D’autre part, il est acquis que le moteur principal de l’adsorption sur des nanoparticules d’oxyde est la diminution de l’énergie de surface. Ce phénomène est bien connu dans le cas de la croissance cristalline. Comme nous l’avons expliqué dans le chapitre I, l’énergie de surface d’une particule est inversement proportionnelle à sa taille ( ! P = 2″ r ). Les cristaux vont croître par adsorption d’ions sur des sites réactifs ce qui augmente leur diamètre, diminue l’énergie du système et stabilise thermodynamiquement les cristallites. L’adsorption d’ions en surface des nanoparticules va avoir le même effet de stabilisation thermodynamique des nanoparticules.
La saturation de la surface de particules avec une couche de polyhèdres d’As III, engendre une augmentation de la taille des particules de 0,5 nm. Cette évolution de la taille diminuera seulement de 2% la pression en surface de particules de 20 nm contre 8-10% dans le cas des nano-maghémites de 6 nm. Ceci est illustré par la Figure III.2, montrant la variation de la pression de surface des particules en fonction de leurs diamètres. Ainsi, l’adsorption de 8 As III/nm2 , c’est-à-dire une couche dense où les cations d’As III se placent en position cristallographique sur les sites tétraédriques vacants des nanomaghémites, augmente significativement la taille des particules. Ce mécanisme induit une meilleure stabilité thermodynamique des particules et s’apparente fortement à un mécanisme de croissance cristalline.