Comportement à la corrosion localisée de l’acier doux C15 en présence de chlorures et de
Bioadjuvant
Comportement à la corrosion de l’acier doux C15 en milieu chlorures
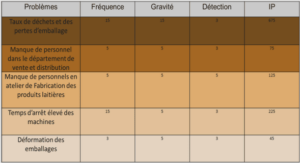
La corrosion induite par pénétration de chlorures n’est possible que lorsque la concentration en chlorures dans le milieu atteint un seuil critique [1] dont la valeur reste encore à ce jour mal connue. En particulier, elle dépend fortement du milieu d’étude et plus spécifiquement du rapport [Cl- ] / [OH- ]. Le pH est alors un paramètre déterminant pour l’initiation de la corrosion par les chlorures. En effet, une hypothèse souvent avancée concerne la compétition entre les chlorures et les hydroxydes : les ions chlorure catalysent la dissolution de la couche passive alors que simultanément les ions hydroxydes favorisent sa reconstitution (cicatrisation).
Influence de la concentration en chlorures sur le comportement anodique de l’acier doux C15
Les courbes de polarisation anodique de l’acier doux C15 obtenues après 60 h d’immersion à Ecorr dans les solutions S1 et S2 en comparaison avec celle obtenue dans la solution de référence NaOH 0,1 M sont présentées sur la figure V.1.Il faut noter que contrairement aux résultats présentés précédemment, les courbes anodiques ont été tracées avec une vitesse de balayage de 0,5 mV/s. En effet, il est impossible de travailler en conditions stationnaires car en présence d’une telle concentration en ions chlorure (≥ 0,5 mol/L) une polarisation prolongée induit la destruction de la couche passive formée à la surface. En présence de chlorures, les deux courbes ont la même allure. Elles présentent un palier de passivité dont la longueur (quelques centaines de mV) dépend de la concentration en ions chlorure. La valeur du courant de palier n’est pas très différente avec et sans chlorures, et est de l’ordre de quelque µA. La valeur du potentiel de corrosion Ecorr est quant à elle beaucoup plus cathodique en présence de chlorures que dans une solution ne contenant que de la soude : sa valeur est de l’ordre de -0,9 V/ESS en présence de chlorures, valeur très cathodique par rapport à celle obtenue en absence de chlorures (-0,7 V/ESS). Ce résultat est en accord avec les nombreuses études de la littérature, et en particulier avec les travaux d’Abd el Haleem et al.[2] pour lesquels le potentiel de corrosion devient de moins en moins noble lorsque la concentration en chlorures augmente. Dans la solution S1, une concentration en ions chlorure de 0,5 mol/L permet encore la cicatrisation de l’acier par effet de l’hydroxyde de sodium et ce jusqu’à un potentiel de -0,3 V/ESS. Il a été montré que l’initiation de la corrosion par piqûre est le résultat d’un mécanisme d’adsorption des ions à la surface de l’acier [3] et qu’il y a compétition entre l’adsorption des ions chlorure et les ions OHà la surface. Ainsi, la présence de ce pseudopalier de passivité montre bien que sur ce domaine de potentiel le processus de cicatrisation de la couche d’oxydes par les ions OH- l’emporte sur le processus de destruction de la couche d’oxydes par les ions chlorure [4,5]. Une brusque augmentation du courant à E = -0,3 V/ESS pour la solution S1, et à E = -0,5 V/ESS pour la solution S2 est observée. Ce potentiel est correspond au potentiel de piqûration et sa valeur augmente en fonction de la concentration en ions chlorure dans le milieu. Ce résultat est aussi en accord avec la littérature qui rapporte que le risque de corrosion augmente quand le rapport [Cl- ]/[OH- ] augmente [6,7]. La figure V.2 présente les différents diagrammes d’impédance tracés à Ecorr dans les solutions S1 et S2 en comparaison avec celui obtenu dans la solution NaOH 0,1 M.