La gestion des risques dans les essais cliniques
Outils et recommandations
Depuis plusieurs années, des pharmaciens hospitaliers se réunissent pour définir précisément leur rôle dans la recherche clinique. En effet, bien que les BPC fixent les responsabilités du La gestion des risques dans les essais cliniques 36 pharmacien responsable des essais cliniques, elles ne précisent pas les modalités pratiques qui permettent d’assurer le bon fonctionnement de l’organisation. Plusieurs sociétés savantes ont publié des recommandations sur les missions du pharmacien responsable des essais cliniques : l’American Society of Health Systems Pharmacists40, la Société Canadienne des pharmaciens d’hôpitaux et, en ce qui concerne la France, la Société Française de Pharmacie Clinique (SFPC). En effet, dès 1998, la SFPC a mis au point un Manuel d’Auto-Evaluation de Pharmacie Hospitalière41 Ce manuel fixe des directives et recommandations relatives à différents domaines de la PUI, dont les essais cliniques. En 2010, la SFPC a publié un Référentiel de Pharmacie Hospitalière4 sur le modèle du manuel de certification des établissements de santé de la HAS. Ce document met en avant trois critères pour la gestion des essais cliniques à la PUI : la confidentialité, l’organisation de l’activité et la maitrise du circuit du médicament expérimental. En 2001, la Société Canadienne des pharmaciens d’hôpitaux a publié des lignes directrices sur l’utilisation des médicaments expérimentaux dans les établissements de santé43 . Récemment, une équipe de pharmaciens hospitaliers québécois a mis au point un outil d’auto-évaluation de la pratique pharmaceutique dans les essais cliniques44 . Par ailleurs, des publications récentes ont démontré l’intérêt de directives claires pour l’application des BPC en PUI45,46 et proposent des outils aux pharmaciens afin de les aider dans la gestion des traitements expérimentaux. Ces outils permettent de traduire en termes pharmaceutiques ce qui est attendu d’un pharmacien responsable des essais cliniques. Ils soulignent l’importance des Procédure Opératoire Standard (POS), ou Modes Opératoires Normalisés (MON) au Canada. Ce sont des « instructions détaillées et écrites visant à assurer l’accomplissement uniforme d’une fonction particulière ». Les POS sont des références qui guident les professionnels de santé (pharmaciens, investigateurs et associés) à chaque étape de la recherche clinique. En ce qui concerne les méthodes de gestion des risques évoquées précédemment, la recherche clinique est assez peu analysée. Un travail a été récemment réalisé sur le circuit logistique du médicament expérimental à la PUI47, mais la prise en charge médicamenteuse globale dans les essais cliniques n’a jamais fait l’objet d’une analyse des risques approfondie.
Gestion des dysfonctionnements
Les acteurs de la recherche clinique disposent d’outils leur permettant de déclarer les dysfonctionnements en vue d’analyser et de mettre en œuvre des actions. En vertu de l’arrêté du 6 avril 2011, chaque PUI est dotée d’un système de management de la qualité (SMQ) qui s’appuie, entre autres, sur la déclaration des non-conformités (NC). La déclaration des non-conformités s’applique aussi au secteur « essais cliniques » et se fait le plus souvent de façon 37 spontanée lorsqu’un dysfonctionnement est repéré. Parfois, les non-conformités sont identifiées par l’ARC lors des visites de monitoring à la PUI. A cette occasion, l’ARC et le pharmacien relèvent conjointement les non-conformités à travers la rédaction d’un compte-rendu de monitoring. Depuis 2003, une structure commune à tout l’APHP gère l’ensemble des signalements d’erreurs et dysfonctionnements sur l’ensemble de l’activité de soins. Ce système, dénommé OSIRIS et accessible par le biais d’un Intranet, est très utilisé (39000 signalements entre 2004 et 2010)48 . OSIRIS n’est pas spécifique des essais cliniques, mais il est parfois utilisé pour signaler des dysfonctionnements dans le circuit du médicament expérimental.
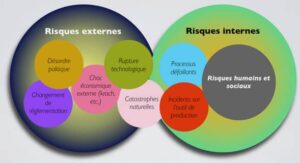
Une organisation à consolider
Des drames récents survenus lors d’essais de phase I ont ébranlé le public et les professionnels de santé (Londres 2006, Rennes 2016). Même si ces incidents sont probablement le fait d’aléas thérapeutiques, ils posent le problème de la sécurité dans les essais cliniques. Lors de l’élaboration de ce projet, j’ai été informée qu’un cas d’erreur médicamenteuse a été déclaré à l’ARS Ile-de-France en 2014. Cet incident concernait un surdosage en médicament expérimental suite à un glissement de tâches. Ce dysfonctionnement dans le circuit du médicament expérimental a montré les vulnérabilités de notre organisation et la nécessité de la consolider. Nous nous proposons d’évaluer l’ensemble de l’organisation par une vision transversale et pluridisciplinaire.