Modèles de dégradation des déchets et de production de biogaz
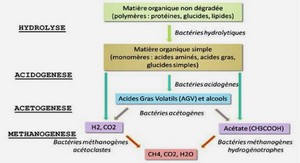
Ce chapitre comporte trois parties principales. La première est une introduction suivie par une étude bibliographique des modèles simplifiés de dégradation anaérobie des déchets et de production de biogaz de type I. Ces modèles sont basés principalement sur des cinétiques de dégradation des déchets solides de premier ordre. La production de biogaz est déterminée directement à partir des déchets solides dégradés sans considérer les processus biologiques et la biomasse participant à ces processus. Cette partie est suivie par la description du modèle de type I que nous avons développé pour notre modèle de couplage. La deuxième partie introduit les modèles de dégradation de type II qui sont basés sur le modèle de croissance microbienne de Monod (1949) et qui considèrent le rôle de la biomasse méthanogène dans la production de gaz et de chaleur. À la fin de cette partie nous introduisons le modèle de type II que nous avons développé pour le modèle de couplage, en insistant sur le rôle de la teneur en eau et de la température des déchets sur l’activé des microorganismes et la dégradation anaérobie des déchets. Pour simplifier le modèle et éviter une longue liste des paramètres à identifier, nous avons simplifié notre modèle en utilisant une seule population méthanogène mésophile. Considérant les valeurs de température observées et signalées dans différentes études et l’importance des microorganismes thermophiles (Lanini, 1998), nous avons ajouté dans un second temps une population thermophile dans le modèle. Finalement la troisième partie comporte une étude bibliographique effectuée sur les paramètres thermiques et biologiques nécessaires pour chaque type de modèle de dégradation. % Pour pouvoir modéliser les phénomènes biologiques durant la dégradation anaérobie des déchets, nous devons connaître d’abord ces phénomènes, les différentes phases de dégradation, les familles de microorganismes qui participent à chaque phase et les paramètres et processus importants qui influent la dégradation des déchets et la production de biogaz, comme la teneur en eau, la température, la recirculation de lixiviat etc. Nous présentons ici d’abord les différentes CemOA : archive ouverte d’Irstea / Cemagref 54 phases de dégradation et les paramètres clé des modèles de dégradation, et ensuite les modèles de dégradation de type I et de type II. Nous utiliserons désormais le terme – pour définir les microorganismes méthanogènes et acétogènes. Nous utiliserons aussi le terme de « teneur en eau » ou de « saturation » pour définir le caractère humidifiant du lixiviat dans sa composante physique, mais pas biochimique. % -.- Quand les déchets sont placés dans un centre de stockage, la digestion anaérobie expliquée auparavant, au paragraphe 1.2.4 du chapitre 1, ne se produit pas immédiatement. Une période de quelques mois à quelques années est nécessaire pour la croissance des populations microbiennes méthanogènes. Le nombre des phases de dégradation des déchets définies par différents auteurs varie entre trois et six, même plus, dépendant des données disponibles et de l’objectif recherché (Barlaz et al. 1989b). Dans cette partie nous résumons la représentation de la dégradation en quatre phases (Barlaz et al. 1989b). La décomposition des déchets est représentée par la succession d’une phase aérobie, d’une phase anaérobie acidogène, d’une phase anaérobie méthanogène accélérée et d’une phase ralentie de production de méthane. Cette description est basée sur des données de laboratoire. % 5 L’oxygène est présent dans les espaces vides quand les déchets sont stockés. Cet oxygène et celui de l’eau déclenchent la décomposition aérobie. Dans la phase aérobie l’oxygène puis les nitrates sont consommés et les sucres solubles servent de source de carbone à l’activité microbienne. Tous les groupes trophiques nécessaires à la méthanogénèse sont déjà présents dans les déchets jeunes (population cellulolitiques, acidogènes et méthanogènes). Le biogaz est composé de presque 100% de CO2 dans cette phase. La phase aérobie dure seulement quelques jours après la mise en stockage des déchets dans une ISDND et pendant cette phase l’humidité des déchets est généralement inférieure à leur capacité au champ. Comme les déchets jeunes sont stockés sur des déchets plus âgés, les caractéristiques des lixiviats issus de cette phase sont difficilement observables sur site. L’analyse du lixiviat généré par les déchets jeunes, obtenu en pilotes de laboratoire ou sur site, montre parfois des valeurs de Demande Chimique en Oxygène (DCO) d’environ de 104 à 105 mg/l. Cette phase aérobie provoque une montée de température immédiatement après la mise en décharge des déchets qui peut atteindre un pic de 80 °C. Cette élévation de température est imputée aux réactions exothermiques de biodégradation réalisées par les microorganismes aérobies. La température va ensuite diminuer et se stabiliser aux environs de 30 °C à 40 °C (Lanini et al., 1997). Cette première phase de décomposition aérobie des déchets favorise du fait de l’augmentation de température, la croissance ultérieure des populations microbiennes anaérobies. Cette phase a donc probablement une influence très positive sur le démarrage de la biodégradation du massif de déchets et sur l’établissement d’un régime méthanogène stable (Aguilar$Juarez et al., 1999). Il a été estimé que 5 à 15 % de la matière biodégradable était consommée lors de cette première phase de dégradation (INSA$IMFT, 1999), bien que celle$ci ne dure que quelques semaines (pour une couche de déchets donnée). Cette dégradation aérobie de la matière organique rapidement biodégradable pourrait toutefois entraîner une forte concentration en acides gras volatils (AGV) et peut dans certaines circonstances inhiber les phases ultérieures de biodégradation des déchets (Yuen, 1999). CemOA : archive ouverte d’Irstea / Cemagref 55 % $5 $ Dans cette phase, tout l’oxygène des déchets a été consommé et comme les déchets sont recouverts par une nouvelle couche de déchets plus jeunes, la phase anaérobie commence. Dans cette phase les acides carboxyliques sont accumulés, le pH diminue, on peut observer une très légère décomposition de la cellulose et de l’hémicellulose, ainsi que quelques pourcents de méthane dans la composition du biogaz. La première partie de cette phase est caractérisé par l’accumulation rapide des acides carboxyliques et la diminution du pH. En plus des acides carboxyliques, une énorme variété de composés organiques intermédiaires est aussi produite. La forte concentration en CO2, rapportée initialement par Farquhar et Rovers (1973) est le résultat de l’activité fermentative, comme la forte concentration en H2 . CO2 et H2 sont produits essentiellement par la fermentation des sucres. Le méthane n’est en général pas détectable dans cette première partie de la phase acide. La concentration en CO2 et le pH diminuent et la concentration en méthane augmente avec la progression dans la phase acide. L’hydrolyse de la cellulose et de l’hémicellulose n’est pas compatible avec cette phase et il y a peu d’hydrolyse de la phase solide en général, probablement à cause de l’accumulation des acides carboxyliques et de l’inhibition de l’hydrolyse, à faible pH. La production de méthane signale la fin de la deuxième phase et permet l’établissement de la phase suivante. La phase acide peut être présentée en trois étapes : • A »‘ » Durant cette étape, les micro$organismes anaérobies et aérobies facultatifs produisent des enzymes extracellulaires qui hydrolysent les biopolymères (polysaccharides, lipides, protéines) en oligomères et monomères, hydrosolubles. Ainsi, les polysaccharides sont transformés en sucres simples, les matières grasses sous l’action d’exoenzymes particulières (les lipases) donnent des acides gras et du glycérol, produits de faible poids moléculaire assimilable par les micro$ organismes. Enfin, les protéines sont transformées grâce à l’intervention d’enzymes (protéinases) qui vont catalyser la coupure des liaisons peptidiques et détruire ainsi l’arrangement moléculaire. Les protéines dégradées sont ensuite assimilées sous forme d’acides aminés ou sous la forme d’oligopeptides. De l’ammonium peut également être libéré. Cette phase permet aux micro$ organismes de type fermentatif d’incorporer les nutriments (Christensen et Kjeldsen, 1989). La phase d’hydrolyse peut se dérouler en aérobiose partielle. Le passage en anaérobiose se caractérise par une diminution du potentiel d’oxydoréduction et par une forte augmentation de la charge organique des lixiviats (DCO). Cette phase se fait lentement par rapport à l’acidogenèse, elle est donc l’étape limitant du processus de dégradation des déchets. Le taux d’hydrolyse est une fonction du pH, de la température, de la concentration des microorganismes et du type et de la taille des particules de matière organique (Pavlostathis et Giraldo$Gomez, 1991). • ( L’hydrolyse des polymères organiques conduit à la formation de monomères ou de produits de faible poids moléculaire. Ainsi, au cours de cette étape de la biodégradation des déchets, les sucres, les acides aminés et les acides gras obtenus à l’étape précédente sont transformés en alcools, en azote ammoniacal et en acides gras volatils (AGV) tels que l’acide acétique, propionique, butyrique ou valérique par des micro$organismes acidogènes. Les réactions de dégradation du glucose sont présentées comme suit (Vigneron, 2005) : ( ) 22 ( glucose de . 264 ) 1 6126 23 2 2 2 0 − → CHCHOHC COOH ++ COH G −=∆ molkJ 22 2 ( glucose de . 359 ) 1 6126 2 23 2 0 − →+ COOHCHCHHOHC + GOH −=∆ molkJ 22 24 ( glucose de . 215 ) 1 6126 2 3 2 2 0 − →+ COOHCHOHOHC GCOH −=∆++ molkJ 2 ( glucose de . 197 ).