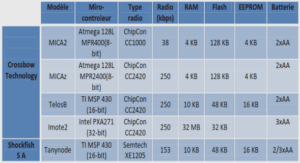
Collecte des données expérimentales
L’inhibition de la croissance d’une population est un indicateur très en vogue, parce qu’il peut être déterminé directement ou indirectement à l’aide d’un équipement électronique. Ce qui permet l’acquisition rapide des observations nécessaires pour les analyses de régression. Nous considérerons la concentration d’inhibition 50% de la croissance (CIC50),Les tests de toxicité ont été réalisés [48,49] en examinant la croissance d’une population de Tetrahymina pyriformis. Les essais ont été menés dans des erlenmeyers de 250 ml, contenant 50 ml d’un milieu dont la composition est précisée ci après :Plusieurs critères ont guidé au choix des composés toxiques examinés. Tous sont disponibles dans le commerce avec une pureté suffisante (95 % et plus), ce qui ne nécessite pas une re-purification préalablement au test. Des précautions ont été observées afin d’assurer une diversité concernant, à la fois, les propriétés physico-chimiques et la position des substituants.
Les solutions stocks des divers composés toxiques, ont été préparées dans le diméthylsulfoxide (DMSO) à des concentrations de 5, 10, 25 et 50 grammes par litre. Dans chaque cas, le volume de solution stock ajouté à chaque fiole est limité par la concentration finale de DMSO qui ne doit pas excéder 0,75 % (350 ml par fiole), quantité qui n’altère pas la reproduction de Tétrahymena [48,49].
Coefficient de partage Octanol/eau (logP)
Le transport, le passage à travers les membranes, la bioaccumulation ou encore l’activité pharmacologique d’une molécule peuvent être conditionnés par son partage entre une phase lipidique et une phase aqueuse, c’est-à-dire son caractère hydrophile. Celui-ci peut être quantifié par le coefficient de partage octanol-eau, noté logP, qui mesure la solubilité différentielle d’un soluté dans ces deux solvants non miscibles [50].C octanol et C H2O sont les concentrations du soluté dans l’octanol et l’eau.La lipophilie, échelle continue, peut avoir aussi bien une valeur positive qu’une valeur négative. Donc, les composés qui ont les valeurs de P > 1 ou logP > 0 sont lipophiles, et les composes qui ont les valeurs de P < 1 ou logP <0 sont hydrophiles.La lipophilie reflète la balance entre deux classes d’interactions intermoléculaires:La première est proportionnelle à la taille du soluté, et la seconde est associée aux groupes fonctionnels. Ainsi, la lipophilie peut être décomposée en deux contributions principales (Carrupt et al, 1997) [51]:
Comme la détermination expérimentale de log P est souvent délicate, de nombreuses méthodes ont été développées pour prédire ce paramètre. Parmi celles-ci, les plus couramment utilisées sont celles qui sont basées sur l’additivité des contributions lipophiles de fragments moléculaires ou atomiques. Elles ne tiennent compte ni de l’aspect tridimensionnel des molécules ni de leur stéréochimie. Pour pallier ce défaut, d’autres techniques dites« Tridimensionnelles » ont été proposées.
Mesure du cœfficient de partage (logP):
L’octanol est un solvant qui possède une polarité très similaire à celle des membranes lipidiques, c’est pourquoi il est utilisé pour évaluer le caractère lipophile d’une molécule,donc sa capacité à se bioaccumuler dans les organismes vivants.Méthode du flacon agité :La plus classique et la plus fiable des méthodes de détermination du logP est la méthode dite du « flacon agité » [52].Cette méthode consiste à mélanger une quantité connue de soluté dans un volume connu d’octanol et d’eau, puis de mesurer la distribution du soluté dans chaque solvant. La méthode la plus courante pour mesurer cette distribution est la spectroscopie UV/Visible.Cette méthode comporte des avantages :• Méthode la plus précise, pour la gamme la plus large de solutés (neutres comme chargés)• La structure chimique n’a pas besoin d’être connue avant de commencer la procédure. Et des inconvénients :Une méthode plus rapide de détermination du logP utilise la chromatographie liquide haute performance (HPLC) [52]. Le logP d’un soluté peut être déterminé par corrélation entre son temps de rétention et celui de composés similaires avec un logP connu.Cette méthode a l’avantage d’être rapide (5-20 minutes par échantillon), mais présente certains inconvénients :• La structure chimique du soluté doit être connue avant de procéder à la détermination.• Puisque le logP est habituellement déterminé par régression linéaire, on doit connaître le logP de plusieurs composés avec une structure similaire.
Prédiction du coefficient de partage octanol/eau:
Cette propriété physico-chimique peut être mesurée, mais ces mesures sont généralement longues et coûteuses. Par conséquent, différentes méthodes de prédiction du logP ont été mises au point, et il existe un nombre important de logiciels de prédiction de cette propriété. Ceux-ci s’appuient aussi bien sur des méthodes de contribution de groupes (ACD/LogP[53], KOWWIN [46], CLOGP [45,]…) que sur des régressions multilinéaires à partir de descripteurs (VLogP [54]) ou sur des réseaux de neurones (AUTOLogP[55]).Dans les bases de données, on peut trouver près de 30 000 structures organiques dont les valeurs de logP expérimental sont disponibles, ce nombre est cependant négligeable comparé au nombre des structures pour lesquelles les données de log P sont fortement demandées, En effet, il y a un intérêt continuel pour le développement de méthodes de calculs de log P à partir de la structure moléculaire.
La première méthode de calcul de logP a été développée par Hansch et Fujita (système ) [56]. Les imperfections relevées ont conduit Rekker à développer la première approche de contribution fragmentaire [57-60].Puisque la définition de fragment peut être ambiguë, (Broto et al) [61], suivis par d’autres, ont développé des systèmes de calcul basés sur des contributions atomiques. Toutes les méthodes qui divisent les molécules en sous- structures, sont appelées approches de sous-structure. L’utilisation exclusive des sous- structures atomiques caractérise des méthodes de contribution d’atomes, tandis que l’utilisation additionnelle de plus grands groupes est typique pour des méthodes fragmentaires. L’addition des contributions des sous-structures conduit finalement a la valeur de logP.