Télécharger le fichier original (Mémoire de fin d’études)
Génome du virus
Le génome rétroviral est constitué de deux molécules identiques d’ARN monocaténaires de 9181 nucléotides et possède neuf cadres de lecture ouverts (Open Reading Frames, ORFs). Trois de ces cadres de lecture codent pour les polyprotéines Gag, Gag-Pol et Env, qui sont par la suite clivées en protéines individuelles. D’abord, le précurseur Env (ou gp160) génère les deux protéines qui forment l’enveloppe virale : la protéine de surface SU (ou la gp120) et la protéine transmembranaire TM (ou la gp41). Ensuite, outre la protéine p6, le précurseur de 55 Kda, le Gag (Pr55Gag), donne les protéines structurales de la matrice (MA ou p17), de la capside (CA ou p24) et de la nucléocapside (NC ou p7). Enfin, l’autocatalyse de la polyprotéine Gag-Pol (Pr160 Gag-pol) génère la protéase (PR), l’intégrase (IN) et la transcriptase inverse (Reverse transcriptase, RT), protéines qui assurent les fonctions enzymatiques du virus. D’autre part, les six autres cadres de lecture produisent les protéines suivantes : Tat (Transactivator of transcription) et Rev (Regulator of viral expression) qui assurent des fonctions de régulation génique, Vpu (Viral protein U), responsable de l’assemblage viral,Vif (Viral infectivity factor), Vpr (Viral protein R) et Nef (Negative factor) qui possèdent diverses fonctions. Les gènes tat et rev codent pour des protéines virales régulatrices qui sont essentielles à la réplication virale. Par contre, les gènes Nef, Vif, Vpr et Vpu codent pour des protéines accessoires puisque leur expression n’est généralement pas essentielle à la réplication du VIH1 in vitro. Mais ces protéines auxiliaires demeurent requises pour la réplication virale et la pathogenèse in vivo. Notons que le VIH-2 ne possède pas le gène Vpu mais le gène Vpx. (HASELTINE, 19091 ; WANG et al. 2000)[69]. La protéase s’autoclive du précurseur gag-pol puis participe à la maturation des protéines de structure et des protéines enzymatiques en clivant les précurseurs protéiques gags et gag-pol. LTR: long terminal repeat. Nef: negative effector. Rev: régulator of expression of virionproteins. Tat: transactivator of transcription. vif: virion infectivity factor. Vpu: viral protein u. vpr: viral protein r.
Diversité génétique du VIH
Le VIH se caractérise par une très grande diversité génétique (Figure 4). Cette variabilité génétique résulte des erreurs de copies effectuées par la reverse transcriptase (RT) lors de la réplication et elle est située essentiellement au niveau de la région hypervariable de l’enveloppe [45]. On distingue actuellement quatre groupes de VIH-1[36] :
Le groupe M (Major) : le plus rependu dans le monde. Neuf sous types ont été identifiés (A, B, C, D, F, G, H, J et K) variant de 20% à 30% de l’un à l’autre. Le sous type B est retrouvé en Europe, en Amérique et en Australie. Les sous types non B sont retrouvés en Afrique et en Asie ;
Le groupe O (Outlier) : Originaire du Cameroun et du Gabon. Ses sous types sont plus rares ;
Le groupe N (New group) : non M, non O originaire du Cameroun ;
Le groupe P (Putative) : identifié en 2009, chez des patients d’origine Camerounaise. Quant au VIH-2 qui a été isolé en 1985 chez des patients originaires d’Afrique de l’Ouest, il comporte huit sous-types [36].
Propriétés physico chimiques du VIH
Réplication virale
Le cycle de réplication du VIH est basé sur la connaissance des différentes cellules cibles du VIH et des étapes de réplication du virus.
Cellules cibles du VIH
Les cellules sensibles à l’infection VIH sont la sous population de lymphocytes T CD4+ auxiliaires, en particulier les lymphocytes mémoires. D’autres cellules sont également sensibles ; il s’agit : des macrophages, les cellules dendritiques, les cellules de Langerhans ainsi que les cellules microgliales du cerveau. Ces cellules, souvent présentatrices d’antigènes, ainsi que les lymphocytes T CD4+ au repos, jouent un rôle important de réservoirs viraux, de dissémination et d’entrée du virus dans l’organisme. Dans d’autres cellules, les virus sont simplement emprisonnés sans se répliquer. C’est le cas des cellules folliculaires dendritiques présentes dans les centres germinatifs des ganglions [2]. Si la molécule CD4 fonctionne comme un récepteur de haute affinité pour la gp120, des récepteurs accessoires sont nécessaires à la pénétration du virus dans la cellule hôte : les corécepteurs « Cystéine ChemokineReceptor » de type 5 (CCR5) et la fusine encore appelée CX « ChemokineReceptor » de type 4 (CXCR4). Les étapes de la réplication virale
Les principales étapes du cycle du VIH réplicatif sont communes à tous les rétrovirus. Leur connaissance est essentielle à la compréhension de la physiopathologie de l’infection VIH. Cette réplication est un cycle comprenant les phases suivantes :
La phase de pénétration du virus dans la cellule hôte ;
La phase de transcription et d’intégration génomique ;
La phase de transcription du pro virus ;
La phase d’assemblage et de libération des virus.
Chacune de ces étapes constitue une cible potentielle pour une thérapeutique antirétrovirale (ARV). La figure ci-dessous illustre les différentes phases de la réplication du VIH.
Phase de pénétration du virus dans la cellule hôte L’entrée du virus dans la cellule cible s’effectue grâce à une reconnaissance entre la glycoprotéine externe du VIH et son récepteur sur la cellule hôte. Cette interaction induit un changement conformationnel de la gp120 suite à la reconnaissance d’une région particulière de cette protéine, par des corécepteurs tels que la Cystéine Chemokine Receptor de type 5 (CCR5) et la fusine encore appelée CX Chemokine Receptor de type 4(CXCR4). Il en résulte une fusion de l’enveloppe virale avec la membrane de la cellule grâce à la GP 41 : c’est l’attachement. Le matériel infectieux du virus fusionne avec la cellule: c’est la pénétration.
Phase de transcription et d’intégration du génome
Après une décapsidation, la transcriptase inverse contenue dans le virion infectieux effectue la transcription inverse de l’ARN viral en ADN double brin pro viral. L’ADN est acheminé dans le noyau où il est intégré dans les chromosomes de la cellule hôte, par l’action d’une autre enzyme codée par le virus : l’intégrase., Cette étape correspond à l’intégration. Le provirus peut ainsi rester inactif au niveau du génome de la cellule infectée ou produire activement de nouveaux virions.
Phase de transcription du provirus
L’ADN proviral est transcrit en ARN messager (ARNm) par l’ARN polymérase II cellulaire. Les ARNm précoces transcrits codent pour les gènes régulateurs et en particulier les gènes tat, rev et nef. La protéine tat, dont l’absence entraînerait un arrêt immédiat de la transcription, active la réplication virale. Les ARNm tardifs transcrits, codent pour les protéines gag, pol, env, vif, vpr, vpu (ou vpx) (Figure 11). Enfin, la protéine rev favorise le transport des ARNm tardifs codant pour les protéines des structures du virus du noyau vers le cytoplasme.
Table des matières
INTRODUCTION
PREMIERE PARTIE : RAPPELS SUR L’INFECTION A VIH
1. GENERALITES SUR L’INFECTION A VIH
1.1. Définition
1.2. Epidémiologie du VIH
1.2.1. Situation globale de l’infection dans le monde
1.2.2. En Afrique sub-saharienne
1.2.3. Ampleur de l’infection à VIH au Sénégal
1.3. Physiopathologie de l’infection à VIH/SIDA
1.3.1. Agent pathogène
1.3.2. Structure du virus
1.3.3. Génome du virus
1.3.4. Diversité génétique du VIH
1.3.5. Propriétés physico chimiques du VIH
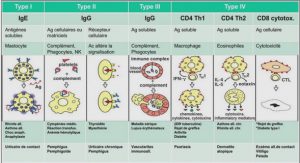
1.3.6. Les réponses immunes
1.4. Histoire naturelle du VIH
1.4.1. Primo-infection
1.4.2. Phase de séro-positivité asymptomatique
1.4.3. Phase d’immunodépression mineure.
1.4.4. Phase d’immunodépression sévère ou SIDA
1.5. Classification de la maladie à VIH
1.6. Diagnostic biologique de l’infection à VIH
1.6.1. Diagnostic indirect « sérologique » de l’infection à VIH
1.6.2. Diagnostic direct de l’infection à VIH
2. PRISE EN CHARGE GLOBALE DE L’INFECTION AVIH
2.1. Prise en charge psychosociale
2.2. Prise en charge nutritionnelle
2.3. Prise en charge clinique
2.4. Prise en charge paraclinique
2.5. Prise en charge thérapeutique
2.5.1. Prise en charge par les médicaments antirétroviraux (ARV)
2.5.1.1. Buts
2.5.1.2. Moyens
DEUXIEME PARTIE : TRAVAIL PERSONNEL
1. CADRE D’ETUDE
1.1. Environnement externe du district sanitaire de Ndoffane
1.1.1. Caractéristiques géophysique de la commune de Ndoffane
1.1.2. Caractéristiques sociodémographiques et religieuses
1.1.3. Caractéristiques économiques
1.1.4. Données épidémiologiques
1.1.4.1. Présentation physique
1.1.4.2. Organisation administrative
1.1.4.3. Organisation de la prise en charge des PVVIH
2. MATERIEL ET METHODE
2.1. Type et période d’étude
2.2. Population d’étude
2.2.1. Critères d’inclusion
2.2.2. Critères de non inclusion
2.2.3. Contraintes
2.3. Recueil des données..
2.3.1. Les données épidémio-cliniques
2.3.2. Les données paracliniques
2.4. Saisie et analyse des données
3. RESULTATS
3.1. Aspects épidémiologiques
3.1.1. Répartition des patients selon le sexe
3.1.2. Répartition des patients selon l’âge
3.1.3. Répartition des patients selon la provenance
3.1.4. Répartition des patients selon la profession
3.1.5. Répartition selon la situation socio-économique
3.1.6. Répartition selon la situation matrimoniale
3.1.7. Répartition des patients selon le régime matrimonial
3.1.8. Répartition des patients selon la nationalité
3.1.9. Répartition des patients selon le mode de contamination
3.1.10. Répartition des patients selon le profil sérologique
3.2. Aspects cliniques
3.2.1. Répartition des patients selon les circonstances de diagnostic
3.2.2. Répartition des patients selon les antécédents d’infections opportunistes
3.2.3. Répartition des patients selon le type d’infection opportuniste
3.2.4. Répartition des patients selon le poids à l’inclusion
3.2.5. Répartition des patients selon l’IMC (indice de masse corporelle)
3.2.6. Répartition des patients selon l’état général
3.2.7. Répartition des patients selon la fièvre à l’inclusion
3.2.8. Répartition des patients selon le type de signes respiratoires
3.2.9. Répartition des patients selon le type de signes digestifs
3.2.10. Répartition des patients selon le type de signes dermatologiques
3.2.11. Répartition des patients selon le type de signes neurologiques
3.2.12. Répartition des patients selon le stade clinique de la CDC
3.2.13. Répartition des patients selon le stade OMS
3.3. Aspects paracliniques
3.3.1. Répartition des patients selon la biologie à l’inclusion
3.4. Aspects thérapeutiques
3.4.1. Répartition des patients selon l’institution ou non d’une prophylaxie au cotrimoxazole
3.4.2. Répartition des patients selon l’institution ou non d’une prophylaxie à l’isoniazide
3.4.3. Répartition des patients selon le schémathérapeutique
3.4.4. Répartition des patients selon le schéma en fonction du régime
3.4.5. Répartition des patients selon les molécules utilisées
3.4.5.1. Selon le type de NUC
3.4.5.2. Selon le type de NNUC
3.4.5.3. Répartition des patients selon le type d’IP
3.5. Aspects évolutifs
3.5.1. Répartition des patients selon l’observance
3.5.2. Évaluation de l’efficacité
3.5.2.1. Clinique :variation des poids semestriels
3.5.2.2. Immunologique : variation des taux de CD4 semestriels des patients
3.5.3. Evaluation de la tolérance
3.5.3.1. Répartition des patients selon la survenue ou non d’effets secondaires
3.5.3.2. Répartition des patients selon le type d’effets secondaires
3.5.4. Modalités évolutives
DISCUSSION
CONCLUSION ET RECOMMANDATIONS
REFERENCES BIBLIOGRAPHIQUES
ANNEXES