Télécharger le fichier original (Mémoire de fin d’études)
DEUXIEME PARTIE
SYNDROME SEC
Le syndrome sec est le résultat d’une diminution de sécrétion d’une ou plusieurs muqueuses de l’organisme. Les atteintes oculaires (xérophtalmie) et salivaires (xérostomie) sont les plus fréquentes. Toutefois, il existe d’autres cibles potentielles de cette hyposécrétion que sont la peau [41], les muqueuses nasale, bronchique et vaginale [53]. Cette affection peut avoir des causes diverses : pathologiques (certaines maladies de système syndrome de Gougerot-Sjögren, infections virales…), médicamenteuses, une post exposition à une radiothérapie, physiologiques, (vieillissement) et les médicaments. Les sensations de sécheresse buccale ou oculaire sont couramment rapportées, pourtant elles restent assez subjectives. Il est nécessaire de les mettre en évidence par des tests pouvant être effectués en routine [43]. Le diagnostic de syndrome sec est important pour identifier l’étiologie, proposer des solutions adaptées aux patients et améliorer leur confort.
Syndrome de Gougerot – Sjögren
Le SGS peut être défini comme étant une exocrinopathie auto-immune chronique. Les glandes exocrines, surtout salivaires et lacrymales, sont le siège d’une infiltration lymphocytaire, ceci aboutissant à l’apparition de xérostomie et/ou xérophtalmie. Dès lors qu’un syndrome sec est mis en évidence, il faut rechercher s’il est imputable ou non au syndrome de Gougerot-Sjögren (SGS). On parle de syndrome puisqu’il s’agit d’un ensemble de symptômes. A noter qu’un patient atteint par le SGS ne présente généralement pas tous les symptômes pouvant être rattachés à ce syndrome. Il se peut aussi qu’il y ait un décalage dans la chronologie d’apparition des symptômes.
Epidémiologie
L’incidence du SGS n’a pas fait l’objet d’études systématiques. Les études disponibles sont des estimations partielles auxquelles il ne faut accorder qu’une valeur très relative [35]. L’incidence actuelle du SGS est de 4 cas pour 100 000 habitants dont 70% avaient un SGS primitif [13]. Selon les critères utilisés, la prévalence du SGS varie de 0,2% à 2,7% [41]. Cette variabilité de la fréquence estimée est en partie due aux différences entre les critères de classification utilisés, mais aussi à la différence entre l’âge des groupes étudiés et aux différentes méthodes employées pour apprécier l’hypofonctionnement salivaire et lacrymal [58]. Les études microscopiques mettant en évidence des lésions histologiques des glandes salivaires compatibles avec la maladie sont retrouvées dans 0,44 % des cas. La fréquence de l’anticorps anti-SSA est de l’ordre de 1/1000 cas dans la population générale [25].Le SGS est considéré comme l’une des maladies auto-immunes les plus répandues. Il viendrait au deuxième rang des maladies auto-immunes, derrière la polyarthrite rhumatoïde (PR) (prévalence 1%) [51] ; mais devant le lupus érythémateux disséminé (LED) (prévalence 0,03%). Il reste cependant une pathologie peu connue et moins étudiée que le LED [11]. La répartition selon le sexe donne une très nette prédominance du sexe féminin avec un sex ratio d’environ 10/1. Le pic d’âge varie entre 40 et 50 ans mais le SGS peut survenir à tout âge [13]. C’est le plus souvent vers 45 ans qu’apparaissent les premiers symptômes. Son début est le plus souvent très insidieux, monosymptomatique, si bien que le diagnostic est posé 6 à 8 ans après les premières manifestations [11]. La répartition selon l’âge montre que le SGS survient surtout autour de la ménopause, mais avec des extrêmes de 2 à 83 ans [35]. Il a été décrit des formes familiales qui affectent en général les femmes (mère-fille ou couple de sœurs) dans une même famille [66]. Le SGS est un véritable « syndrome carrefour » au sein des maladies auto-immunes en raison de l’existence des formes secondaires. La situation la plus couramment observée est celle du SGS secondaire, notamment à une polyarthrite rhumatoïde dont il émaille l’évolution dans environ 26 à 31% des cas.
Physiopathologie
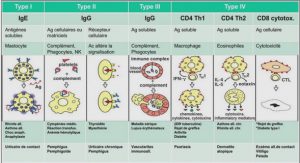
L’infiltration lymphocytaire des parenchymes et la multitude des perturbations immunologiques permettent de classer le SGS primitif parmi les affections auto-immunes. Il constitue même un excellent modèle pour l’étude de ce type de pathologie car les organes intéressés par le processus (les glandes salivaires et accessoires) et les cellules impliquées sont très aisément accessibles et se prêtent assez facilement aux analyses les plus sophistiquées [31].L’origine de cette affection, comme la plupart des maladies auto-immunes, est inconnue. Le modèle proposé de la pathogenèse du Syndrome Sec est que les personnes génétiquement prédisposées sont exposées à des facteurs environnementaux tels que l’infection virale, qui conduisent à une réponse auto-immune prolongée centrée sur les cellules épithéliales des glandes exocrines. Cependant, les spécificités de ces voies ne sont pas bien comprises, et la relation pathogène entre la maladie autoimmune initiale des glandes exocrines et les autres atteintes extra-glandulaires est inconnue [42]. Les différentes étapes qui conduisent à la physiopathologie globale de la maladie et à son expression principale, commencent à être précisées. Pour mieux comprendre la physiopathologie du SGS dans son ensemble, il est d’abord nécessaire de s’intéresser à chacun des multiples intervenants impliqués, environnementaux ou personnels, qu’il s’agisse de cellules, de virus, de messagers chimiques ou encore de récepteurs [41].
Étude clinique
Dans les premiers temps, les manifestations sont souvent mono-symptomatiques et d’évolution plutôt lente, à b s bruit, ceci explique qu’il existe un certain retard au diagnostic évalué en moyenne à 8 années [30]. Le SGS est caractérisé sur le plan clinique par l’association d’une kératoconjonctivite sèche, d’une xérostomie, et de manifestations générales de nature immuno-inflammatoire. Ce syndrome peut être isolé, on parle dans ce cas du SGS primitif, ou bien il peut être associé à d’autres maladies auto-immunes et on parle de SGS secondaire.
Symptomatologie
La symptomatologie du syndrome sec est liée au tarissement des sécrétions exocrines évoluant par poussées, parfois précédée d’inflammation glandulaire.
Signe oculaires
Elle est Parfois précédée d’une phase d’hypertrophie des glandes lacrymales et d’hypersécrétion La sécheresse oculaire se traduit par une impression de corps étranger ou de brûlures oculaires, un prurit, ou des kérato-conjonctivites sèches répétées et éventuellement compliquées. Le test de Schirmer est positif quand l’imprégnation d’un papier buvard dans le cul-de-sac lacrymal inférieur pendant 5min est inferieur a1cm. Le test au rose Bengale permet de visualiser les zones sèches de la conjonctive et de la cornée, et les ulcérations débutantes après imprégnation par un colorant, et examen à la lampe à fente.
Signes buccaux
L’infiltration lymphoplasmocytaire des glandes salivaires, en particulier des glandes sous-maxillaires et salivaires accessoires, provoque le tarissement de la sécrétion de la salive et l’apparition d’une xérostomie [35].
Signes fonctionnels
Au stade initial, les signes fonctionnels sont souvent discrets, uniquement retrouvés grâce à un interrogatoire minutieux et orienté. Au cours de l’évolution de la maladie, ils se majorent et deviennent la source d’un important handicap fonctionnel, compromettant la qualité de vie des patients et retentissant sur leur psychisme. La sécheresse buccale continue appelée aussi xérostomie est le symptôme principal de l’atteinte des glandes salivaires. La xérostomie s’exprime par une sensation de bouche sèche, pâteuse gênant parfois la mastication, l’élocution et la déglutition des aliments secs. Elle peut obliger le patient à la prise répétée de gorgées de liquide en parlant ou en mangeant conduisant parfois à un véritable syndrome polyuro-polydipsique [30]. Le patient se plaint secondairement de difficultés pour avaler, d’un manque de stabilité de ses prothèses dentaires amovibles, d’une incidence accrue de caries, de brûlures chroniques de la muqueuse buccale, d’une intolérance aux aliments épicés ou acides, d’une incapacité à manger des aliments secs ou de parler de manière continue pendant quelques minutes [28]. Le gout s’altère. L’état dentaire se détériore, les caries, l’usure précoce et la chute des amalgames aboutissent à l’édentation progressive [9]. Les patients sont aussi plus sujets à un reflux gastro-oesophagien en raison d’une évacuation ralentie de l’acide gastrique et la diminution de l’effet tampon de la salive [28].
Table des matières
INTRODUCTION
PREMIERE PARTIE : GENERALITES SUR LES GLANDES SALIVAIRES ET LA BIOPSIE DES GLANDES SALIVAIRES ACCESSOIRES
I. Anatomie topographique des glandes salivaires
I.1. Glandes salivaires principales
I.1.1. Glande Parotide
I.1.2. Glande submandibulaire
I.1.3. Glande sublinguale
I.2. Glandes salivaires accessoires
I.3. Anatomie de la lèvre inferieure
I.3.1. Histologie des glandes salivaires accessoires
I.3.1.1. Acinus muqueux
I.3.1.2. Acinus séreux
I.3.1.3. Acinus mixte
I.3.2. Physiologie de la salivation
II. Biopsie des glandes salivaires accessoires
II.1. But
II.2. Moyens
II.3. Indications
II.4. Technique opératoire
II.5. Résultats
DEUXIEME PARTIE : SYNDROME SEC
I. Syndrome de Gougerot – Sjögren
I.1. Epidémiologie
I.2. Physiopathologie
I.3. Étude clinique
I.3.1. Symptomatologie
I.3.1.1. Signe oculaires
I.3.1.2. Signes buccaux
I.3.1.3. Signes fonctionnels
I.3.1.4. Signes physiques
I.3.1.5. Autres signes
I.4. Examen anatomopathologique
II. Sarcoïdose
III. Amylose
IV. Polyarthrite rhumatoïde
TROISIEME PARTIE : LA PLACE DE LA BIOPSIE DES GLANDES SALIVAIRES ACCESSOIRES DANS LE DIAGNOSTIC DU SYNDROME SEC
I. Justificatif
II. Objectifs de l’étude
II.1. Général
II.2. Spécifiques
III. METHODOLOGIE
III.1. Type et durée de l’étude
III.2. Cadre d’étude
III.3. Population de l’étude
III.4. Procédure de collecte des données
III.5. Variables de l’étude.
III.5.1. Variables démographiques
III.5.2. Variables cliniques
III.6. Variables paracliniques
III.7. Analyse des données
IV. Résultats
IV.1. Statistiques descriptives
IV.1.1. Données sociodémographiques
IV.1.1.1. Age
IV.1.1.2. Sexe
IV.1.1.3. Profession
IV.1.1.4. Profil du prescripteur
IV.1.2. Données cliniques
IV.1.2.1. Diagnostic de présomption
IV.1.2.2. Nombre de prélèvements
IV.1.2.3. Suites opératoires
IV.1.2.4. Données anatomopathologiques
IV.2. Statistiques analytiques
IV.2.1. Diagnostic de présomption et âge
IV.2.2. Diagnostic de présomption et prescripteur.
IV.2.3. Diagnostic de présomption et conclusion anatomopathologique
V. Discussion
V.1. Aspects sociodémographiques
V.2. Aspects cliniques
V.3. Aspects anatomopathologiques
CONCLUSION
REFERENCES
ANNEXE