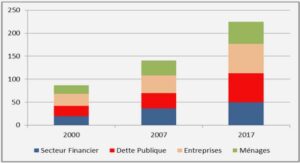
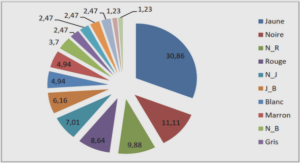
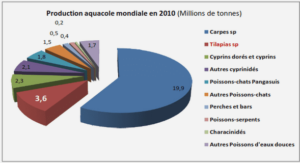
Télécharger le fichier original (Mémoire de fin d’études)
L’altimétrie Nadir delay/Doppler
L’altimètre Doppler se base sur un principe similaire au traitement SAR des radars imageurs. La taille de l’antenne embarquée étant petite, elle possède une mauvaise résolution. Le radar à synthèse d’ouverture permet de recréer une antenne dite « synthétique » en augmentant de ma-nière artificielle sa taille dans la direction de déplacement du satellite, assurant ainsi une meilleur résolution du système dans cette dimension. Cette technique permet également de différencier, grâce au traitement Doppler, les pixels radar entre eux au sein de la fauchée. À la différence des SAR classiques à visée latérale, l’altimètre Doppler fonctionne toujours pour des angles de visées Nadir, ce qui introduit une ambiguïté quant à la différenciation de l’origine du signal retour entre la partie droite et gauche de la fauchée. À la différence de l’altimétrie Nadir conventionnelle, la fréquence de répétition des impulsions (PRF 3) est très grande pour bien échantillonner la bande Doppler relative à une petite antenne. Un traitement SAR est alors appliqué aux échos retour per-mettant d’améliorer la résolution dans la direction azimut, par exemple, une résolution de l’ordre de la centaine de mètre contre 10 km en altimétrie conventionnelle. Le concept d’altimétrie Nadir Doppler permet donc d’améliorer la résolution au sol par rapport à l’altimétrie conventionnelle, mais présente également un fort intérêt pour les zones de transitions, c’est-à-dire, des surfaces comme les lacs, les fleuves, ou encore les côtes. Nous aborderons plus en détails le principe du SAR dans le paragraphe suivant.
L’altimétrie à large fauchée
Le concept de l’altimétrie large fauchée (Li and Goldstein [1990]; Rodriguez and Martin [1992]; Rosen et al. [2000]) utilise un instrument interférométrique légèrement dépointé de la visée Nadir avec un traitement SAR dans la direction azimut. Contrairement aux radars imageurs qui utilisent souvent l’interférométrie multipasses (plusieurs survols successifs d’une même zone sont effec-tués, comme par exemple les satellites ERS-1 et ERS-2), l’altimétrie interférométrique exige une configuration monopasse pour faire face à la variabilité de la surface océanique. Les acquisitions sont faites par deux antennes portées par la même plateforme qui forme alors la base interféro-métrique. Nous développons ici les principes de base, dans un premier temps du SAR et ensuite de l’interférométrie radar. Nous faisons des liens avec la mission SWOT le cas échéant. Les différents principes énoncés dans ce paragraphe sont inspiré du livre de Massonnet and Souyris [2008].
Le radar imageur
Le radar à ouverture réelle (RAR 4) permet d’imager une surface éclairée. Le fonctionnement d’un radar est différent d’un instrument optique (à l’exception des LIDAR 5) car il fait de la discri-mination de cibles en distance et non angulaire. En effet, un radar va mesurer un temps de trajet de l’onde électromagnétique émise, c’est la vision distance du radar (range vision). L’image obtenue par un radar imageur dépend du déplacement du porteur de l’antenne, qui vise latéralement par rapport au sens de déplacement (appelé direction cross-track 6). Le radar émet des impulsions, chaque implusion éclaire une bande de surface que l’on souhaite aussi petite que possible. La fauchée, qui définit les dimensions de l’image, est déterminée par les distances Near Range (NR, distance proche) et Far Range (FR, distance lointaine). Les caractéristiques du RAR sont illustrées sur la figure 1.4 suivante où L correspond à la longueur de l’antenne dans la direction azimut (aussi appelée direction along-track 7), Vs at est la vitesse de déplacement du satellite sur son orbite, raz est la résolution dans la direction azimut du RAR.
• La fréquence porteuse f0, c’est la fréquence de l’oscillateur de l’instrument, également ap-pelée fréquence électromagnétique du radar. Cette fréquence est reliée à la longeur d’onde électromagnétique par la relation : λ0 = c/ f0, où c est la vitesse de la lumière.
• La fréquence d’échantillonnage en distance fd , définit le temps de l’impulsion du radar, elle est reliée à la durée de l’impulsion par la relation : τd = 1/ fd . Cette fréquence permet de définir la résolution distance du radar qui s’exprime, en prenant compte du trajet aller-retour du radar
Le SAR interférométrique
Le SAR conventionnel permet de mesurer la position d’une cible dans un plan (range, azimut). Le développement de l’interférométrie SAR (InSAR 9, voir Li and Goldstein [1990]; Rodriguez and Martin [1992]; Rosen et al. [2000]) a permis de mesurer la troisième dimension, qui n’est autre que la hauteur. Cette technique est particulièrement bien adaptée aux missions topographiques, ce qui est le cas de la mission SWOT.
Le principe de l’interférométrie radar est assez simple. Deux images radar observées à partir de deux antennes voisines ont des délais de propagation de leurs signaux presque identiques mais des phases différentes. En interférométrie, le signal complexe de la première image est multiplié par le conjugué du signal de la deuxième image (après co-registration des deux images), cela cor-respond simplement à une différence de phase des deux signaux. La contribution inconnue des cibles élémentaires à l’intérieur de la cellule de résolution est éliminée dans le calcul de la phase différentielle. La phase différentielle est alors proportionnelle au délai de propagation de la phase entre les deux images. Cette opération consiste à former un interférogramme.
Considérons maintenant la géométrie du système interférométrique, comme illustré sur la figure 1.8 où :
• Hs at est l’altitude du satellite par rapport au plan moyen de la surface d’eau
• η est la variation de la hauteur d’eau autour du plan moyen au point considéré
• θ est l’angle de visée en incidence par rapport à la verticale de l’antenne S1
• R1, respectivement R2, est la distance de l’antenne S1, respectivement S2, au point considéré
• B est la distance du mât qui sépare les deux antennes (Baseline en anglais)
Le délai entre les deux phases des deux signaux complexes s1 et s2 associés, respectivement aux antennes S1 et S2, se rapporte alors à une différence de chemin entre les deux antennes :
∆R=R2−R1 (1.15)
Il existe deux modes de fonctionnement d’un système interférométrique :
• le mode dit « standard », ou encore appelé « non ping-pong », est un mode de fonctionnement où une antenne émet (par exemple S1) et les deux antennes reçoivent le signal diffusé (S1 et S2).
• le mode dit « ping-pong » dans lequel chaque antenne émet et reçoit alternativement les si-gnaux radars.
La mission SWOT
Le projet SWOT : Surface Water Ocean Topography est un projet en collaboration entre le labo-ratoire JPL 10 de la NASA 11 et le CNES 12 (Lee-Lueng et al. [Mission Science Document]). C’est une mission altimétrique innovante dont l’instrument principal KaRIn, Ka Radar Interferometer, est un SAR interférométrique à faible incidence en bande Ka. L’interféromètre devrait fonctionner en mode « standard » (« non ping-pong »). L’objectif principal de cette mission est d’améliorer la cou-verture spatio-temporelle des mesures altimétriques océaniques mais aussi d’étendre les mesures altimétriques à l’hydrologie continentale (lacs, rivières, etc…).
L’instrument KaRIn a deux modes de fonctionnement :
• Un mode océanographie, ou encore mode LR (Low Rate), spécifique à la mesure altimé-trique sur océans permettant une précision de hauteur altimétrique de 1 à 2 cm sur une surface d’ 1 km2.
• Un mode hydrologie, ou encore mode HR (High Rate), spécifique à la mesure altimétrique hydrologique, pour la surveillance des réserves d’eau douce de la planète. La précision es-pérée est de l’ordre de 11 cm (après moyennage sur des surfaces de 1 km2) sur la mesure de hauteurs d’eau et une détection des lacs de dimensions supérieures à 250×250 m2 (objectif ≥ 100×100 m2) et des rivières dont la largeur est supérieure à 100 m (objectif ≥ 50 m).
Les caractéristiques principales de l’instrument KaRIn et du satellite SWOT sont résumées dans le tableau 1.1. L’incidence proche Nadir de visée de SWOT fait que la taille des pixels au sol (pg ) varie fortement le long de la fauchée range. Elle s’étend de 60 m en Near Range jusqu’à 10 m en Far Range. La fauchée en range de SWOT s’étend de 10 km en Near Range par rapport à la verticale jusqu’à 60 km en Far Range.
Stratégie de traitement du mode LR :
Afin de diminuer la quantité de données à envoyer au sol, on augmente la taille des pixels en pro-cédant à un moyennage distance et azimut. La synthèse SAR n’est pas complète, le processus de moyennage s’effectue à bord sur 9 impulsions successives (appelées burst), ce qui donne, pour un ensemble de 9 impulsions successives, 9 pixels de 250 m en azimut (la résolution azimut du RAR étant d’environ 2 km). Le processus de moyennage à bord est un processus de synthèse SAR non focalisée, c’est-à-dire que l’erreur de phase ∆φ(t ) (voir équation 1.23) n’est pas corrigée sur les vues. La condition d’application du processus de synthèse non focalisée est que l’évolution de la distribution de phase en azimut reste inférieure à π/4 durant le processus de moyennage : ∆φ(t ) ≤ π/4. Cette étape nécessite de moyenner des échos radar cohérents entre eux. Les pixels sont ensuite sommés entre eux, tant qu’ils se trouvent à une distance inférieure ou égale à la taille du pixel final (1 km) du premier pixel sommé. La sommation des pixels de 250 m permet la réduc-tion du bruit sur le pixel final, bruit dont l’amplitude décroît en 1/ N avec N le nombre de pixels de 250 m sommés. Ce processus est appelé processus multi-vues (multi-look en anglais). Pour des pixels de 250 m, des vues décalées de 15 m (= 9 × paz , voir équation 1.3) et une taille finale de pixel de 1 km, environ 50 vues successives peuvent être sommées (N=(1000-250)/15). La moyenne spatiale range, pour aboutir à des pixels de 1 km, est obtenue en groupant les échantillons suivant leurs tailles dans la fauchée (de 60 m à 10 m).
Influence d’une surface d’observation mouvante
L’observation des surfaces d’eau présente une difficulté principale pour l’altimétrie à large fau-chée. En effet, les surfaces observées bougent au cours du temps, et donc entre les différentes acquisitions radars et interférométriques. Nous présentons dans ce paragraphe les différentes er-reurs sur la synthèse SAR et sur la phase interférométrique dues aux mouvements de la surface observée.
Erreurs sur le processus de synthèse SAR
Nous reprenons ici les principes énoncés dans le paragraphe 1.1.3.2 mais en considérant cette fois-ci une surface observée qui évolue dans le temps. Les effets dûs aux mouvements orbitaux des vagues ont longuement été étudiés (Raney [1971, 1980]; Alpers and Rufenach [1979]; Rufenach and Alpers [1981]). Le mouvement de cette surface entraîne un déplacement de la distance surface – satellite au cours du temps, comme représenté sur la figure 1.9.
Erreurs d’estimation de la hauteur d’eau
Une cellule de résolution est composée de différentes cibles élémentaires cohérentes spatia-lement. La phase du signal rétrodiffusé est alors la somme des phases élémentaires de ces cibles
16 Chapitre 1 – Les enjeux scientifiques actuels de l’altimétrie en bande Ka élémentaires, qui peuvent s’annuler si celles-ci sont en opposition de phase ou se renforcer si leurs phases sont proches. Ces phases de diffusion forment le phénomène de scintillement (speckle en anglais) qui donne cet aspect granulaire aux images SAR. La contribution de l’ensemble des cibles élémentaires donne un aspect aléatoire à la phase de rétrodiffusion et est représentée par une loi uniforme entre [−π; π]. Cet effet de speckle ne rend pas avantageux l’estimation de la phase in-terférométrique Φ sur une seule impulsion radar. Il est préférable de l’estimer sur un échantillon de NL vues successives. Un estimateur non-biaisé modulo 2π de cette phase interférométrique est l’estimateur du minimum de vraisemblance (Rodriguez and Martin [1992])
Les suspensions
A l’aide du petit appareil de filtration, un volume déterminé d’eau (entre 250 ml et 1000 ml) est filtré pour le calcul de la charge de matières en suspension. Le filtre est ensuite stocké dans des boîtes de pétris et séché à l’air libre au laboratoire avant la pesée. Pour les analyses chimiques des MES, un volume plus important d’eau est filtré (jusqu’à 30 L) pour obtenir une quantité suffisante de matière.
Les sédiments
Le prélèvement s’effectue sur la rive du fleuve (ou les deux lorsque c’est possible) dans des piluliers. Au laboratoire, les échantillons sont séchés à l’air libre, puis désagrégés et tamisés.
LES ANALYSES ELEMENTAIRES
Les analyses des anions sont réalisées sur une Chromatographie Gazeuse HPLC (High Performance Liquid Chromatography), Dionex DX 300, la précision des mesures est de 5%. Les cations sont analysés sur une Absorption Atomique, Perkin Elmer 5100 ZL, avec une précision de 5%. Notons aussi que quelques gouttes de Lanthane sont ajoutées dans l’échantillon lors de l’analyse du calcium, pour éviter des interférences. Ces analyses sont effectuées sur les équipements du LMTG.
L’alcalinité a été mesurée en laboratoire par titration avec la méthode de Gran.
Les tests de reproductibilité effectués sur un échantillon naturel (eau de l’Ariège) donnent une erreur de 2% sur la mesure. Cette mesure de la précision est détaillée dans ce chapitre.
Les analyses de la concentration en COD sont réalisées sur un Shimadzu TOC- 5000. La précision est de 0,2 mg.l-1.
Les éléments traces sont déterminés par ICP-MS (Inductively Coupled Plasma – Mass Spectrometry) sur un Elan 6000 (Perkin Elmer) avec une précision de 10%.
Pour les isotopes du strontium, un passage sur des colonnes cationiques (Sr-Spec) est effectué avant l’analyse sur un TIMS (Thermo Ionisation Mass Spectrometry) Finnigan-Mat 261 au LMTG.
Pour les isotopes du CID, l’extraction du CO2 se fait sur la rampe installée au LMTG au début de cette étude. Les détails du protocole d’extraction ainsi que les différents tests réalisés sur la ligne avant sa mise en service sont présentés un peu plus loin dans ce chapitre. Après la récupération du gaz dans les ampoules, les analyses isotopiques sont réalisées sur le spectromètre de masse (VG Optima 602) au Centre de Géochimie de Surface (CGS) à l’Université Louis Pasteur de Strasbourg.
Test de reproductibilité sur les mesures de l’alcalinité et de la teneur en COD
Ce travail de recherche étant principalement axé sur les mesures de la signature isotopique du Carbone Inorganique Dissous dans les eaux de surface, je me suis particulièrement attardé sur les mesures de l’alcalinité et la concentration en COD.
J’ai effectué un prélèvement sur l’Ariège en amont de Toulouse pour faire des tests de reproductibilité de la mesure d’alcalinité. Lors de ce prélèvement, j’ai aussi conditionné, avec du chlorure mercurique (HgCl2), quelques échantillons afin de réaliser des tests de reproductibilité de la mesure isotopique du CID dans une eau naturelle.
J’ai réalisé, sur un titrimètre TRITINO 716 DMS (Metrohm), 30 titrations de l’alcalinité de l’eau de l’Ariège avec un acide HCl de 3,94.10-3 M. L’alcalinité a été déterminée par la méthode de Gran (Gran, 1952). Les résultats de l’alcalinité sont représentés dans le Tableau IV. La valeur moyenne de l’alcalinité est de 1870 μmol.l-1, l’écart-type est de 30 μmol.l-1. Ce résultat correspond à une erreur de 2% sur la valeur.
Cette erreur est acceptable pour notre travail.
En ce qui concerne le COD, il existe plusieurs protocoles de préservation des échantillons, soit par acidification (avec de l’acide chlorhydrique, HCl, ou de l’acide ortho phosphorique, H3PO4), soit avec du chlorure mercurique (HgCl2) pour éviter toute activité bactérienne. J’ai effectué des tests comparatifs de ces protocoles sur des échantillons d’eau prélevés dans le petit bassin situé dans le patio du laboratoire. Pour faire ces tests, j’ai choisi 5 modes de conditionnements des échantillons : brut, HgCl2, HgCl2 + HCl, HCl et H3PO4. Les échantillons sont tous filtrés à 0,22 μm et stockés dans des bouteilles en pyrex préalablement lavées. J’ai ensuite effectué des mesures de la teneur en COD le jour du prélèvement, 15 jours, 1 mois, 6 mois et 1 an après. Entre chaque analyse, les échantillons sont conservés dans une chambre froide à une température de +5°C. Cette série de tests va nous permettre une comparaison de l’effet du conditionnement sur les échantillons au cours du temps, sur une période d’une année. L’ensemble de ces résultats est présenté sur Figure 8 et le Tableau V.
L’échantillon brut présente les valeurs les plus faibles (moyenne sur les 5 analyses : 4,56 mg.l-1) et on observe une diminution de la teneur en fonction du temps de stockage (de 4,74 mg.l-1 le 18 avril 2001 à 4,38 mg.l-1 le 13mars 2002). Dans le cas des autres échantillons (traités avec des acides ou du mercure) la mesure est stable dans le temps (± 0,2 mg.l-1, correspondant à l’erreur sur la mesure (erreur machine + erreur chimie)), à l’exception d’une analyse du 09 mai 2001 sur l’échantillon traité avec HgCl2+HCl, où l’on a mesuré une teneur en COD de 5,64 mg.l-1 que l’on peut attribuer à une mauvaise manipulation. En effet, pour chacune des analyses, un ou deux duplicates ont été réalisés. Les valeurs présentées représentent la valeur moyenne. Dans le cas de cet échantillon, nous avons obtenu une valeur de 4,99 et de 6,29 mg.l-1.
Les deux échantillons traités avec de l’acide chlorhydrique présentent des valeurs légèrement plus élevées que les échantillons traités avec de l’acide ortho-phosphorique (H3PO4) ou du chlorure mercurique (HgCl2). Ces échantillons, préservés avec de l’acide ortho-phosphorique (H3PO4) ou du chlorure mercurique (HgCl2), semblent mieux se conserver, avec des valeurs moyennes sur l’ensemble des mesures de 4,86 mg.l-1 et 4,72 mg.l-1 respectivement. La valeur moyenne des échantillons traités avec le chlorure mercurique se rapproche le plus de la valeur moyenne de la mesure de la teneur en COD de notre échantillon le jour du prélèvement. Nous avons donc choisi d’utiliser ce traitement pour nos échantillons.
LES ANALYSES ISOTOPIQUES
Il existe deux méthodes pour effectuer des analyses de la signature isotopique du CID dans les eaux de surface. La première consiste à précipiter le carbone inorganique dissous sous forme de SrCO3 en ajoutant un chlorure de strontium ammoniaqué (NH4OHSrCl2) (Gleason et al, 1969 ;Barnes et al, 1978). La seconde méthode consiste à traiter l’échantillon avec du chlorure mercurique (HgCl2) pour éviter toute modification du CID par l’activité bactérienne dans le flacon. Le flacon est rempli jusqu’à ras bord. Lors de la fermeture du flacon, il ne faut pas piéger des bulles d’air dans le flacon pour éviter une contamination et un équilibrage avec du CO2 d’origine atmosphérique. L’extraction du CO2 s’effectue ensuite dans une ligne d’extraction sous vide. Le CID est dégazé sous forme de CO2 par ajout d’acide phosphorique concentré (Mook, 1968, 1970 ;Kroopnick, 1970, 1974 ;Tan et al., 1973 ; Games et Hayes, 1974 ; Reardon et al., 1979).
Dans le cadre de notre étude nous avons travaillé avec la deuxième méthode.
Le spectromètre de masse
Principe
Le principe de la spectrométrie de masse est de dévier inégalement les particules d’un faisceau en fonction de leur masse de manière à former un spectre de masse.
L’analyse isotopique consiste à comparer les courants ioniques correspondant à chacun des isotopes, ce qui suppose une bonne stabilité de ces courants, une bonne optique ionique et un vide aussi poussé que possible dans l’appareil pour éviter la dispersion du faisceau et la perturbation du spectre par des traces de résiduels.
Le spectromètre de masse peut se diviser en 3 parties :
– la source des ions. Selon les éléments que l’on souhaite analyser, la source peut être soit solide soit gazeuse. Dans le cas d’une source solide (comme par exemple pour les analyses isotopiques du strontium), l’échantillon est déposé sur un filament métallique porté à haute température (thermo-ionisation). Pour le δ13C, la source est de type gazeuse. Dans ce cas les ions sont obtenus par bombardement électronique du gaz dans une chambre d’ionisation. Quelque soit le type de source, les ions sont ensuite accélérés sous une différence de potentiel. Cette accélération est obtenue en portant l’ensemble de la chambre d’ionisation et de ses accessoires à un potentiel positif par rapport au reste de l’enceinte relié à la terre. Les ions sont extraits de la chambre d’ionisation à travers une fente de très faible largeur par une première électrode extractive. Les ions passent ensuite dans un ensemble plus ou moins complexe de plaques jouant le rôle de lentilles électrostatiques dont le but est de les accélérer et de les focaliser sur la fente de sortie. La largeur de la fente de sortie influe sur le pouvoir séparateur de l’appareil.
Performances
Les performances du spectromètre de masse sont caractérisées par la sensibilité et le pouvoir de résolution de l’appareil. Le spectre de masse est un spectre de raies de largeur théorique nulle. En pratique, ces raies sont enregistrées sous forme de pics de largeurs finies ΔM. le pouvoir de résolution de l’appareil est mesuré par le rapport M/ΔM.
LA MISE EN PLACE DE LA RAMPE D’EXTRACTION DE CO2
La rampe d’extraction
La rampe d’extraction du CO2 (Figure 9) peut se décomposer en quatre parties :
Le réacteur : c’est un récipient (dont la capacité peut varier entre 0,5 l et 1 l) avec un orifice d’entrée. Cette entrée est bouchée à l’aide d’un bouchon en plastique. C’est à travers ce bouchon que l’échantillon est introduit dans la rampe grâce à une seringue et c’est dans ce récipient que s’effectue le dégazage du CO2.
Les pièges : Il s’agit d’une série de quatre pièges qui permettent de purifier le CO2.
Le tube collecteur : Comme son nom l’indique, c’est dans cette partie de la rampe que le gaz est récupéré après le passage à travers les quatre pièges. Le CO2 est piégé au fond du tube pendant qu’on le selle à l’aide d’un chalumeau.
La pompe : elle permet de maintenir un vide de l’ordre de 10-3 mbar à l’intérieur de la rampe. Ce vide est contrôlé par deux jauges à deux niveaux dans la rampe (au milieu des pièges et en fin de rampe). Ces jauges nous permettent de vérifier la bonne étanchéité de notre rampe et donc d’éviter une contamination par du CO2 atmosphérique ou bien un dégazage de CO2 vers l’extérieur, donc un fractionnement possible du δ13C.
Protocole d’extraction du CO2
– Mettre 1 ml d’acide ortho-phosphorique (100%) dans le réacteur ainsi qu’un agitateur magnétique.
– Installer le réacteur sur la rampe et laisser dégazer l’acide pendant une vingtaine de minutes.
– Fermer la vanne 1, pour isoler le réacteur, et insérer l’échantillon d’eau à travers le bouchon en caoutchouc à l’aide d’une seringue. 5 minutes sont nécessaires après l’introduction de l’échantillon pour que la réaction de dégazage soit complète. L’agitateur magnétique permet d’accélérer cette réaction.
– Fermer la vanne 2 et placer sous le piège A un dewar contenant un mélange propanol-azote liquide à une température de l’ordre de –80°C. Ouvrir la vanne 1 et attendre 5 minutes pour atteindre un équilibre. A cette température et cette faible pression, la vapeur d’eau va se solidifier au fond du piège A, par contre, le CO2 va rester sous une phase gazeuse.
– Après ce laps de temps, la vanne 3 est fermée et on place sous le piège B un Dewar contenant seulement de l’azote liquide (température de –193°C). On peut alors ouvrir la vanne 2 et attendre encore 5 minutes. Le Dewar contenant le mélange propanol-azote liquide est maintenu à une température de –80°C sous le piège A. dans cette configuration, la vapeur va rester piégée dans le piège 1 et le CO2 va se solidifier au fond du piège B.
– La vanne 2 est ensuite fermée et on enlève le Dewar contenant l’azote liquide.
Le piège B revient donc à la température ambiante et donc le CO2 passe à nouveau sous forme gazeuse.
– Ces opérations sont réitérées de proche en proche pour chaque piège. Les temps de piégeages de la vapeur d’eau sont de 10 minutes pour les pièges B et C et de 20 minutes pour le piège D. Les temps de piégeages pour le CO2 sont de 5 minutes pour tous les pièges.
– Après avoir piégé le CO2 dans le piège 4 pendant 5 minutes, on ouvre la vanne 5, sans enlever le Dewar d’azote liquide sous le piège. Cette opération permet d’enlever les gaz non condensables de l’échantillon.
– Ensuite, après avoir piégé l’eau pendant 20 minutes sous le piège D, un Dewar contenant de l’azote liquide est placé sous le tube collecteur (toujours pendant 5 minutes)
– Après ce laps de temps, la vanne 6 est ouverte et on selle le tube à l’aide d’un chalumeau tout en laissant le Dewar d’azote liquide (pour que le CO2 reste piégé au fond du tube).
Volume d’eau nécessaire pour une extraction de CO2 sur la rampe
Le volume de l’échantillon nécessaire pour effectuer une mesure isotopique de la composition isotopique du CID va dépendre de l’alcalinité de l’échantillon. En effet, il faut tout d’abord que l’acide dans le réacteur soit en excès pour être sûr d’avoir un dégazage de tous les ions bicarbonates et carbonates. Il faut aussi que la quantité de gaz récupéré dans le tube collecteur soit suffisante pour faire une analyse au spectromètre de masse.
Dans la pratique, pour chaque extraction, on met entre 1 et 1,5 ml d’acide orthophosphorique dans le réacteur, et on ajuste le volume d’eau selon l’alcalinité mesurée dans l’échantillon. Le Tableau VI résume les volumes d’eau nécessaires pour obtenir suffisamment de gaz pour une analyse.
Table des matières
INTRODUCTION GENERALE
CHAPITRE I : LE CYCLE DU CARBONE ET LES COMPOSITIONS ISOTOPIQUES DES RESERVOIR DE CARBONE
I. Le cycle du carbone et les signatures isotopiques des différents flux et réservoirs
1. Le cycle du carbone organique
2. Le cycle du carbone inorganique
II. Les isotopes stables 12C et 13C du carbone
1. Expression des rapports isotopiques et fractionnement isotopique
2. Le système végétation–sol–eaux de surface
III. Utilisation des isotopes stables du carbone
1. Dans les sols
2. COP, COD dans les fleuves
3. CID dans les fleuves
CHAPITRE II : MATERIELS ET METHODES
I. Les sites d’etudes et les prélévements sur le terrain
1. Les sites d’études
2. Les techniques d’échantillonnage
II. Les analyses élémentaires
III. Les analyses isotopiques
IV. La mise en place de la rampe d’extraction de CO2
CHAPITRE III : ÉTUDE DE BASSINS VERSANTS ELEMENTAIRES
Introduction
I. Le bassin versant de Nsimi Zoétélé (Cameroun)
1. Présentation générale du bassin
2. Résultats
3. Discussion
4. Conclusion
II. Le bassin versant du Strengbach
1. Présentation générale du bassin
2. Résultats
3. Discussion
4. Conclusion
III. Comparaison des deux bassins versants
IV. Conclusion
CHAPITRE IV : LES GRANDS BASSINS VERSANTS
I. Le bassin du Nyong
1. Présentation du bassin
2. Résultats
3. Discussion
4. Conclusion
II. Les fleuves de Patagonie
1. Présentation des bassins versants
2. Résultats
3. Discussion
4. Conclusion
III. Le bassin versant de la Têt
1. Description du bassin versant
2. Résultats
3. Discussion
4. Conclusion
IV. Les bassins versants de l’Hérault et du Rhône
1. Présentations des bassins versants
2. Résultats
3. Discussion
4. Conclusion
V. Les bassins versants de l’Inde
1. Présentation des bassins
2. Résultats
3. Discussion
4. Conclusion
VI. Le bassin du Paraná et de l’Uruguay
1. Présentation du bassin
2. Résultats
3. Discussion
4. Conclusion
VII. Le bassin de l’Amazone
1. Présentation générale
2. Résultats
3. Discussion
4. Conclusion
VIII. Conclusion
CHAPITRE V : FACTEURS DE CONTROLE ET BILAN GLOBAL A L’OCEAN
Introduction
I. Sources et facteurs de contrôle
1. A l’échelle des petits bassins élémentaires
2. A l’échelle des grands bassins fluviaux
3. Variations du δ 13CCID dans les eaux de surface
II. Bilan aux océans
III. Conclusion
CHAPITRE VI : PREMIERS ELEMENTS D’UNE MODELISATION DE L’EVOLUTION DU δ13CCID DANS LES EAUX DE SURFACE
Introduction
I. Présentation des deux modèles : δ-Carb et CARAIB
1. Le modèle δ-Carb
2. Le modèle CARAIB
II. Premiers résultats et discussion
1. Le modèle CARAIB
2. Le modèle δ-carb
3. Conclusion
CONCLUSION
REFERENCES
ANNEXES