RESSION OSMOTIQUE
Le phénomène d’osmose Solutions diluées : apparition du phénomène d’osmose dû à la différence de concentration des deux côtés d’une membrane. Seules les molécules d’eau passent à travers la membrane, les ions Na+ et Cl- sont arrêtés. Flux d’eau à travers la membrane s’arrête lorsque pressions d’eau intérieure et extérieure identique. La pression osmotique est la différence de pression à l’équilibre, des deux côtés de la paroi semi-perméable.π = Pi – Pe = Pi(NaCl) – Pe(NaCl) La dilatation ou la contraction de la cellule n’est pas due aux molécules d’eau mais uniquement aux molécules de NaCl.
APPLICATIONS
– Montée de la sève dans les érables au printemps (Mmole = 342 g ; C = 29 moles.m-3)
h ≈ 7,2 m C) ne suffit pas à expliquer totalement montée de sève dans les arbres
– Une eau très salée ne désaltère pas,… …
– Saccharose et NaCl
Une cuve de section carrée de 10 cm de côté et de capacité 10 l est séparée en 2 compartiments égaux par une cloison, perméable seulement à l’eau, pouvant être mobile et glisser sans frottement le long de la cuve. 1) La cloison étant d’abord maintenue fixe, on remplit un compartiment d’une solution aqueuse de saccharose à 10 g.l-1 et l’autre d’une solution aqueuse de NaCl (non dissocié) à 20 g.l-1 Calculer la pression osmotique dans chaque compartiment, sachant que T = 300°K. 2) La cloison étant ensuite laissée libre de se mouvoir, dans quel sens et de combien va-t-elle se déplacer ?
Masses molaires (en grammes) : saccharose = 342 chlore = 35,5 sodium = 23
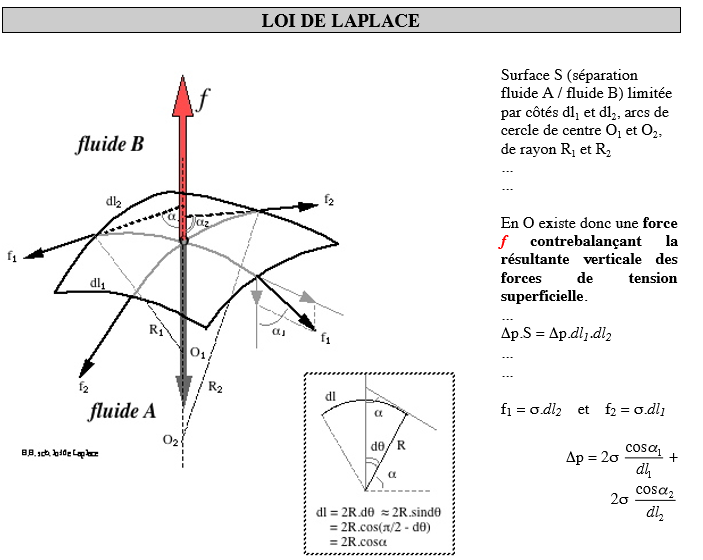
NOTIONS DE TENSION SUPERFICIELLE
Mise en défaut des lois de la statique des fluides : … gouttelettes…ménisques… ascension dans les tubes…insectes sur l’eau… … Phénomènes dus aux interfaces du type liquide-vapeur, liquide-solide et solide vapeur. Echelle macroscopique: pas de mouvements d’ensemble du liquide.
Echelle microscopique: molécules situées à l’interface: subissent une force résultante dirigée vers le liquide La couche superficielle d’un liquide est soumise à une force qui tend à réduire cette surface.