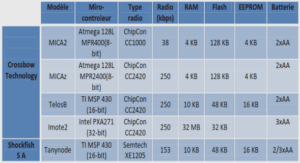
Cas des cycles : le cyclohexane
Les cycles sont des chaînes carbonées fermées sur elle mêmes ce qui limite leur degré de liberté et donc leurs possibilités de déformations. Les petits cycles à 3 ou 4 atomes sont plans et particulièrement rigides; ils ne présentent qu’une seule conformation. Ces structures sont tendues car les contraintes angulaires et stériques sont importantes. Pour le cyclopentane, plan lui aussi mais ne présentant qu’une faible contrainte angulaire, seule une légère distorsion est possible de façon à minimiser les interactions stériques dues à la position éclipsée de tous les substituants du cycle. Pour les cycles de taille supérieure, il s’agit de molécules spatiales qui acceptent certaines déformations pour s’adapter et minimiser les différentes contraintes.
Avec le cyclohexane notamment, les déformations sont possibles et on distingue deux conformations limites : la forme “chaise” et la forme “ bateau”.
Le passage d’une conformation à une autre se fait par basculement d’une des branches du cycle. La représentation de Newmann permet de visualiser clairement la position des substituants les uns par rapport aux autres :
Une liaison située dans un plan sensiblement parallèle au plan moyen du cycle est dite en “position équatoriale”; si elle est située dans un plan perpendiculaire, elle est en “position axiale”. Le retournement de la branche du cycle fait passer un substituant de la position axiale à la position équatoriale et vice versa.
Ainsi dans les deux formes chaises symétriques les positions axiales et équatoriales des substituants sont-elles permutées. En regardant ces figures, on peut remarquer que les substituants en position équatoriale sont dans un environnement plus dégagé que ceux en position axiale pour laquelle il existe une gène entre substituants positionnés en -1,3.
La conséquence de ceci est que :
1) le passage d’un substituant de la position équatoriale à l’axiale s’accompagne d’un gain d’énergie de la molécule qui dépend de la taille et de la nature du substituant : 1,6 kcal/mole pour un méthyl, 5,1 kcal/mole pour un t.butyl.
2) Des substituants volumineux (tertiobutyl, triphénylméthyl… ) se placeront exclusivement en position équatoriale quitte à ce que le cycle prenne la conformation bateau au cas ou la chaise imposerait un tel groupement en axial .
3) Des interactions électroniques favorisent une conformation plutôt qu’une autre; ainsi dans les 1,2- et 1,3 dibromocyclohexanone, les bromes prennent la position axiale ou équatoriale pour minimiser l’effet stérique et surtout la répulsion électronique ; ce comportement illustre la prédominance générale des effets électroniques sur les effets stériques :
– Evolution énergétique du cyclohexane au cours des déformations Le passage d’une conformation à une autre s’accompagne d’un changement de l’énergie de la molécule qui correspond au passage de la conformation chaise à la conformation bateau ( et vice versa) et du changement de nature des liaisons (passage de l’axiale à l’équatoriale et vice versa).
De plus le passage de la chaise au bateau se faisant par redressement d’une des branches du cycle, il existe une position intermédiaire où la branche qui se redresse est dans le plan moyen du cycle; cette position est très instable et correspond au maximum énergétique: c’est la conformation « 1/2 chaise »; enfin l’instabilité due à la position éclipsée des substituants dans la conformation bateau peut être légèrement atténuée par une torsion du cycle: c’est la conformation « bateau tordu ». L’évolution de l’énergie du cyclohexane peut donc être schématisée :
Si le cycle portait des substituants alkyle ou fonctionnels, il faudrait tenir compte de la différence d’énergie introduite lors du changement de nature de la liaison, énergie qui tiendrait compte des effets électroniques et stériques et qui s’ajouterait ou se retrancherait à celle correspondant au changement de conformation du cycle. Les valeurs des barrières de potentiel seraient différentes mais l’allure générale de la courbe serait conservée.
Les conformations des molécules (48,0 KO) (Cours PDF)